题目内容
9.下列各组物质相互混合反应后,最终有白色沉淀生成的是( )①金属钠投入到烧杯中的FeCl2溶液中
②过量氨水溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中
④向NaAlO2溶液中滴入少量NaHSO4溶液
⑤向饱和Na2CO3溶液中通入足量CO2 .
| A. | ①③④⑤ | B. | 只有①④ | C. | 只有③④⑤ | D. | 只有②③④⑤ |
分析 ①钠和水反应生成的氢氧化钠和FeCl2溶液发生复分解反应生成Fe(OH)2,最终生成红褐色的Fe(OH)3;
②氨水为弱碱,不能溶解氢氧化铝;
③少量Ca(OH)2投入过量NaHCO3溶液中发生复分解反应有碳酸钙是白色沉淀生成;
④向NaAlO2溶液中滴入少量NaHSO4溶液,反应生成氢氧化铝沉淀;
⑤向饱和Na2CO3溶液中通入足量CO2会析出白色的碳酸氢钠晶体.
解答 解:①金属钠投入到烧杯中的FeCl2溶液中,发生的反应为:2Na+2H2O=2NaOH+H2 ↑,2NaOH+FeCl2=Fe(OH)2 ↓+2NaCl,4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以最终生成的沉淀是红褐色的,所以不符合,故①错误;
②过量氨水溶液和明矾溶液混合,铝离子和一水合氨反应生成氢氧化铝沉淀,离子方程式:Al3++3NH3•H2O═Al(OH)3↓+3NH4+,氨水为弱碱,不能溶解氢氧化铝,最终有白色沉淀生成,故②正确;
③少量Ca(OH)2投入过量NaHCO3溶液中,氢氧化钙全部反应,发生的反应为:Ca(OH)2+2NaHCO3=CaCO3 ↓+2H2O+Na2CO3,碳酸钙是白色沉淀,所以有白色沉淀生成,故③正确;
④向NaAlO2溶液中滴入少量NaHSO4溶液发生的反应为:AlO2-+H++H2O=Al(OH)3↓,氢氧化铝是白色沉淀,故④正确;
⑤向饱和Na2CO3溶液中通入足量CO2发生的反应为:Na2CO3+H2O+CO2=2NaHCO3,碳酸氢钠的溶解性小于碳酸钠的溶解性,所以向饱和Na2CO3溶液中通入足量CO2会析出碳酸氢钠晶体,所以产生白色沉淀,故⑤正确;
故选D.
点评 本题考查物质之间的化学反应,熟悉复分解反应发生的条件及常见物质的溶解性是解答本题的关键,注意⑤根据物质的溶解度能判断产生沉淀,该题为易错选项,题目难度不大.

| A. |  利用装置萃取苯中的Br2 | B. |  利用装置探究NH3具有氧化性 | ||
| C. |  利用装置测定变质Na2O2的纯度 | D. |  利用装置制备乙酸乙酯 |
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 反应放热还是吸热必须看反应物和生成物具有的总能量的相对大小 | |
| D. | 已知石墨(s)比金刚石(s)稳定,则石墨(s)转化为金刚石(s)要放出能量 |
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾 ⑤品红溶液 ⑥氯化钡.
| A. | ①④⑤⑥ | B. | ②③④⑤ | C. | ①②③⑥ | D. | ②③④⑥ |
| A. | 用标准NaOH溶液滴定锥形瓶中的待测盐酸时,滴定前滴定管尖嘴处有气泡,滴定后气泡消失,会使结果偏高 | |
| B. | 测定氯水的pH,可使用玻璃棒蘸取溶液滴到pH试纸上,再立即与标准比色卡比对读数 | |
| C. | 检验Fe(NO3)2是否氧化变质:先加稀硫酸,再加KSCN溶液,观察溶液是否变红 | |
| D. | 可利用能否发生银镜反应鉴别甲醛和甲酸 |
| A. | 加热 | B. | 向水中通CO2 | C. | 加入明矾晶体 | D. | 加入NaHCO3固体 |
| A. |  制取干燥的氨气 | B. |  检验Fe2+ | C. |  配制溶液 | D. |  分离汽油和水 |

| A. | a只能是淀粉 | |
| B. | 反应①②③均为取代反应 | |
| C. | 乙醇可以与多种氧化剂发生氧化反应 | |
| D. | 乙酸乙酯的羧酸类同分异构体只有1种 |
 (乙基苄基醚),采用如下两条路线进行对比:
(乙基苄基醚),采用如下两条路线进行对比:
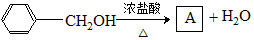


 、C2H5-O-C2H5.
、C2H5-O-C2H5. .
. +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$