��Ŀ����
2���߷��Ӳ���M�ڹ�ۺ���ͽ���Ϳ�Ϸ�������Ҫ��;��M�Ľṹ��ʽΪ��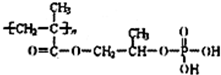
��ҵ�ϳ�M�Ĺ��̿ɱ�ʾ���£�
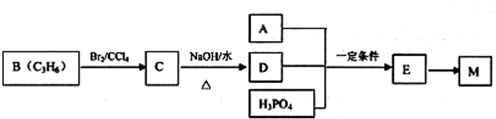
��֪��A��ȫȼ��ֻ����CO2��H2O���������ܶ�����ͬ״���������ܶȵ�43����������H��0ԭ�Ӹ�����Ϊ3��1������Na��Na2CO3���ܷ�Ӧ������ɫ���壮
��1��A�к��еĹ����ŵ�������̼̼˫�����Ȼ���
��2������˵����ȷ����c���������ĸ����
a����ҵ�ϣ�B��Ҫͨ��ʯ�ͷ�����
b��C��ͬ���칹����2�֣�������C��
c��D��ˮ�е��ܽ��Ժܴ�������Cu��OH��2����Һ����Һ�����ɫ
d��E-M�ķ�Ӧ�����۷�Ӧ
��3��д��A+D+H3PO4--E��Ӧ�Ļ�ѧ����ʽ��
 ���÷�Ӧ������������Ӧ��
���÷�Ӧ������������Ӧ����4��F��A��һ��ͬ���칹�壬F�ĺ˴Ź���������ʾ�����������ֲ�ͬ����ԭ�ӣ���������ת����ϵ��
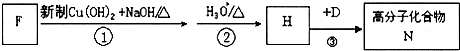
д��F��N�Ľṹ��ʽΪ��F��OHC-CH2-CH2-CHON��
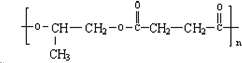
д����Ӧ�ٵĻ�ѧ����ʽOHC-CH2-CH2-CHO+4Cu��OH��2+2NaOH$\stackrel{��}{��}$NaOOC-CH2-CH2-COONa+2Cu2O��+6H2O��
���� BΪ����ʽΪC3H6�������巢���ӳɷ�Ӧ����BΪCH3CH=CH2��CΪCH3CHBrCH2Br��C����ˮ�ⷴӦ����DΪ ��A��ȫȼ��ֻ����CO2��H2O���������ܶ�����ͬ״���������ܶȵ�43����Mr��A��=43��2=86��������H��0ԭ�Ӹ�����Ϊ3��1������Na��Na2CO3���ܷ�Ӧ������ɫ���壬˵�������к����Ȼ���D��A��H3PO4��Ӧ�õ�E��Eת���õ�M�����M�Ľṹ��ʽ��֪��AΪ
��A��ȫȼ��ֻ����CO2��H2O���������ܶ�����ͬ״���������ܶȵ�43����Mr��A��=43��2=86��������H��0ԭ�Ӹ�����Ϊ3��1������Na��Na2CO3���ܷ�Ӧ������ɫ���壬˵�������к����Ȼ���D��A��H3PO4��Ӧ�õ�E��Eת���õ�M�����M�Ľṹ��ʽ��֪��AΪ ��EΪ
��EΪ ����4����F��A��һ��ͬ���칹�壬F�ĺ˴Ź���������ʾ�����������ֲ�ͬ����ԭ�ӣ�����������������ͭ����������Ӧ��˵�������к���-CHO����FΪOHC-CH2-CH2-CHO������������HΪHOOC-CH2-CH2-COOH��H��D�������۷�Ӧ���ɸ߾���N����NΪ
����4����F��A��һ��ͬ���칹�壬F�ĺ˴Ź���������ʾ�����������ֲ�ͬ����ԭ�ӣ�����������������ͭ����������Ӧ��˵�������к���-CHO����FΪOHC-CH2-CH2-CHO������������HΪHOOC-CH2-CH2-COOH��H��D�������۷�Ӧ���ɸ߾���N����NΪ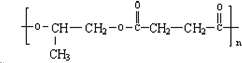 ���ݴ˽��
���ݴ˽��
��� �⣺BΪ����ʽΪC3H6�������巢���ӳɷ�Ӧ����BΪCH3CH=CH2��CΪCH3CHBrCH2Br��C����ˮ�ⷴӦ����DΪ ��A��ȫȼ��ֻ����CO2��H2O���������ܶ�����ͬ״���������ܶȵ�43����Mr��A��=43��2=86��������H��0ԭ�Ӹ�����Ϊ3��1������Na��Na2CO3���ܷ�Ӧ������ɫ���壬˵�������к����Ȼ���D��A��H3PO4��Ӧ�õ�E��Eת���õ�M�����M�Ľṹ��ʽ��֪��AΪ
��A��ȫȼ��ֻ����CO2��H2O���������ܶ�����ͬ״���������ܶȵ�43����Mr��A��=43��2=86��������H��0ԭ�Ӹ�����Ϊ3��1������Na��Na2CO3���ܷ�Ӧ������ɫ���壬˵�������к����Ȼ���D��A��H3PO4��Ӧ�õ�E��Eת���õ�M�����M�Ľṹ��ʽ��֪��AΪ ��EΪ
��EΪ ��
��
��1��������������֪��AΪ �����й�����Ϊ��̼̼˫�����Ȼ����ʴ�Ϊ��̼̼˫�����Ȼ���
�����й�����Ϊ��̼̼˫�����Ȼ����ʴ�Ϊ��̼̼˫�����Ȼ���
��2��a��BΪCH3CH=CH2��Ӧͨ��ʯ�͵��ѻ���ã���a����
b��CΪCH2BrCHBrCH3����Ӧ��ͬ���칹����CHBr2CH2CH3��CH3CBr2CH3��CH2BrCH2CH2Br3�֣�������C������b����
c��DΪ ������2��-OH��������ˮ��������Cu��OH��2����Һ����Һ�����ɫ����c��ȷ��
������2��-OH��������ˮ��������Cu��OH��2����Һ����Һ�����ɫ����c��ȷ��
d��E-M�ķ�Ӧ�ǼӾ۷�Ӧ����d����
�ʴ�Ϊ��c��
��3��A+D+H3PO4-E��Ӧ�Ļ�ѧ����ʽΪ�� ���÷�Ӧ�����ǣ�������Ӧ��
���÷�Ӧ�����ǣ�������Ӧ��
�ʴ�Ϊ�� ��������Ӧ��
��������Ӧ��
��4��F��A��һ��ͬ���칹�壬F�ĺ˴Ź���������ʾ�����������ֲ�ͬ����ԭ�ӣ����ܷ���������Ӧ��˵�������к���-CHO��ӦΪOHC-CH2-CH2-CHO������������HΪHOOC-CH2-CH2-COOH������D�������۷�Ӧ����N��Ϊ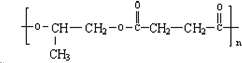 ����Ӧ�ٵĻ�ѧ����ʽΪ��OHC-CH2-CH2-CHO+4Cu��OH��2+2NaOH$\stackrel{��}{��}$NaOOC-CH2-CH2-COONa+2Cu2O��+6H2O��
����Ӧ�ٵĻ�ѧ����ʽΪ��OHC-CH2-CH2-CHO+4Cu��OH��2+2NaOH$\stackrel{��}{��}$NaOOC-CH2-CH2-COONa+2Cu2O��+6H2O��
�ʴ�Ϊ��OHC-CH2-CH2-CHO��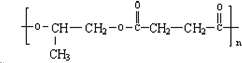 ��OHC-CH2-CH2-CHO+4Cu��OH��2+2NaOH$\stackrel{��}{��}$NaOOC-CH2-CH2-COONa+2Cu2O��+6H2O��
��OHC-CH2-CH2-CHO+4Cu��OH��2+2NaOH$\stackrel{��}{��}$NaOOC-CH2-CH2-COONa+2Cu2O��+6H2O��
���� ���⿼���л�����ƶϣ�ע����B��M�Ľṹ�����ƶϣ����������л���Ĺ����ŵĽṹ�����ʣ���Ŀ�Ѷ��еȣ�

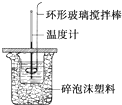 ������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�
������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�������Ͳ��ȡ50mL 0.50mol•L-1���ᵹ��С�ձ��У���������¶ȣ�
������һ��Ͳ��ȡ50mL 0.55mol•L-1NaOH��Һ��������һ�¶ȼƲ�����¶ȣ�
�۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ����¶ȣ�
�ش��������⣺
��1��Ϊʲô����NaOH��ҺҪ�Թ�����ȷ�����ᱻ��ȫ�кͣ�
��2������NaOH��Һ����ȷ������C������ţ���
A���ز�������������
B����������������
C��һ��Ѹ�ٵ���
��3��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������D������ţ���
A�����¶ȼ�С�Ľ���
B���ҿ�ӲֽƬ�ò���������
C����������ձ�
D���������¶ȼ��ϵĻ��β������������ؽ���
ʵ�����������
����д���еĿհף�
| �¶� ʵ����� | ��ʼ�¶�t1�� | ��ֹ�¶�t2/�� | �¶Ȳ�ƽ��ֵ��t2-t1��/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | / |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
���к��Ȳⶨʵ���У����в���һ���ή��ʵ��ȷ�Ե���B��
A���õζ��ܣ���������������������0.01��ȡ���������Һ�����
B��NaOH��Һ�ڵ���С�ձ�ʱ������������
C����С�ձ�������ϴв��ŵ�����ĭ���Ͻ϶�
D������HCl��Һ���¶ȼ���ˮϴ�����������NaOH��Һ���¶ȣ�
| A�� | ��17.18��Ԫ�ض��Ƿǽ���Ԫ�� | |
| B�� | ��14��Ԫ���γɵĻ������������ | |
| C�� | ��3��Ԫ��������� | |
| D�� | ֻ�е�2��Ԫ�ص�ԭ���������2������ |
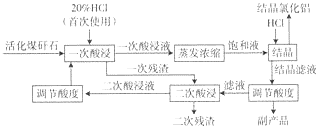
��1���ᾧ��Һ����Ҫ�ɷ���AlCl3��FeCl3��HCl�����β�������Ҫ�ɷ���SiO2���ѧʽ����
��2���ù��������п���ѭ��ʹ�õ����������ᣬѭ�����ø����ʵ��ŵ��dz������ԭ�Ͻ��ͳɱ���ȱ�������ʵĸ������ܻ�Ӱ�����AlCl3•6H2O��Ʒ�Ĵ��ȣ�
��3��Ϊ�˷������β�������Ԫ�صĺ�����ijͬѧ��ȡ5.000g���β������Ƚ���Ԥ����ʹ��Ԫ�ػ�ԭΪFe2+����������ƿ�����Ƴ�100mL��Һ��Ȼ����ȡ25.00mL��1.000��l0-2mol•L-lKMn04����Һ�ζ������ı���Һ20.00mL����֪��ӦʽΪ��Fe2++Mn04-+H+��Fe3++Mn2++H20��δ��ƽ�������β�������Ԫ�ص���������Ϊ4.480%��
��4���±�ΪHClͨ�������AlCl3�ᾧЧ�ʺ�HC1�����ʵ�Ӱ�죮
| HCl�������/��m3��L-1�� | �ᾧЧ��/% | HCl����Ч��/% |
| 0.0375 | 11.8 | 93.2 |
| 0.075 | 31.5 | 89.8 |
| 0.1225 | 59.0 | 83.2 |
| 0.15 | 68.0 | 74.9 |
| 0.1875 | 71.0 | 67.8 |
| 0.225 | 73.1 | 59.1 |
��5�����ᾧ�Ȼ�������һ��������ˮ����lOO��ˮԡ�м������ɼ��ɵõ��ۺ��Ȼ���[Al2��OH��nCl6-n•H20]m���ɽᾧ�Ȼ�����ȡAl2��OH��nCl6-n�Ļ�ѧ����ʽΪ2AlCl3•6H2O$\frac{\underline{\;\;��\;\;}}{\;}$Al2��OH��nCl6-n+nHCl+��12-n��H2O��
| A�� | �����е�SO2����ˮ�������γ����� | |
| B�� | �����ŷŵ�β�������᳧�ͻ��ʳ��ķ��������е������� | |
| C�� | ��ҵ��ˮ�����ŷ�������������Ҫԭ�� | |
| D�� | Ϊ�˼���������γɣ��������SO2���ŷ�������ȼ�������� |
| A�� | KOH | B�� | NaOH | C�� | Ba��OH��2 | D�� | Mg��OH��2 |
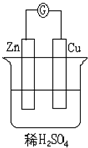 ��ͼ������Ⲣ��գ���ͼ�У�
��ͼ������Ⲣ��գ���ͼ�У�