题目内容
12.室温下,分别把下列物质加入水中,能使水的电离程度增大且所得溶液呈酸性的是( )| A. | K2SO4 | B. | NaHSO4 | C. | NaClO | D. | NH4NO3 |
分析 使H2O的电离平衡向正方向移动,且所得溶液呈酸性,说明该物质是强酸弱碱盐,促进水电离,以此解答该题.
解答 解:A.K2SO4是强酸强碱盐,不促进也不抑制水电离,故A错误;
B.NaHSO4抑制了的水的电离,向逆方向移动,溶液呈酸性,故B错误;
C.根据水的电离平衡H2O=H++OH-知,加入少量NaClO促进了水的电离,向正方向移动,但溶液呈碱性,故C错误;
D.加入少量的NH4NO3,铵根离子水解导致溶液呈酸性,促进水电离,故D正确;
故选D.
点评 本题考查了弱电解质的电离,明确影响水电离的因素及盐的特点是解本题关键,为高频考点,侧重于学生的分析能力的考查,注意把握电解质的电离特点以及盐类的水解,难度不大.

练习册系列答案
相关题目
2.某反应过程中能量变化如图所示,下列有关叙述正确的是( )
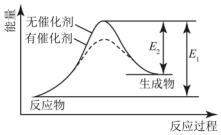

| A. | 该反应为放热反应 | B. | 催化剂改变了化学反应的热效应 | ||
| C. | 催化剂不改变化学反应历程 | D. | 催化剂改变了化学反应历程 |
20.炽热的炉膛内有反应::C(s)+O2(g)=CO2(g)△H=-392kJ•mol-1,往炉膛内通入水蒸气时,有如下反应:
C(s)+H2O(g)=CO(g)+H2(g);△H=+131kJ•mol-1
2CO(g)+O2(g)=2CO2(g);△H=-564kJ•mol-1
2H2(g)+O2(g)=2H2O(g);△H=-482kJ•mol-1.
由以上反应推断往炽热的炉膛内通入水蒸气时( )
C(s)+H2O(g)=CO(g)+H2(g);△H=+131kJ•mol-1
2CO(g)+O2(g)=2CO2(g);△H=-564kJ•mol-1
2H2(g)+O2(g)=2H2O(g);△H=-482kJ•mol-1.
由以上反应推断往炽热的炉膛内通入水蒸气时( )
| A. | 不能节约燃料,但能使炉膛火更旺 | |
| B. | 虽不能使炉膛火更旺,但可节约燃料 | |
| C. | 既可使炉膛火更旺,又能节约燃料 | |
| D. | 既不能使炉膛火更旺,又不能节约燃料 |
7.某粉末状样品由铁、铝、铜三种金属组成,加入过量稀硫酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
| A. | AIO2- | B. | Fe2+ | C. | Fe3+ | D. | Al3+ |
17.下列有关实验或结论的描述正确的是( )
| A. | 向盐酸酸化的Ba(NO3)2溶液中通入SO2,有白色沉淀生成,则BaSO3难溶于酸 | |
| B. | 液溴应保存在磨口玻璃塞的棕色细口试剂瓶中,并加少量水进行水封 | |
| C. | 用酒精萃取碘水中的碘,水从分液漏斗下口放出,碘的酒精溶液从分液漏斗上口倒出 | |
| D. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶内的液面以下 |
4.下列鉴别物质的实验方法正确的是( )
| A. | 用互滴法鉴别偏铝酸钠和盐酸 | |
| B. | 用CuSO4溶液鉴别NaCl和NaNO3 | |
| C. | 用澄清石灰水鉴别SO2和CO2 | |
| D. | 用AgNO3溶液鉴别NaCl溶液和Na2CO3溶液 |
1.能证明氢氟酸是弱酸的实验事实是( )
| A. | HF溶液与Zn反应放出H2 | B. | 0.1mol/LNaF溶液的pH大于7 | ||
| C. | HF溶液与Na2CO3反应生成CO2 | D. | 0.1mol/LHF溶液可使紫色石蕊变红 |