题目内容
【题目】![]() 以
以![]() 和
和![]() 为原料合成尿素是利用
为原料合成尿素是利用![]() 的成功范例。在尿素合成塔中的主要反应可表示如下:
的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:![]()
![]()
反应Ⅱ:![]()
![]()
总反应:![]()
![]()
请回答下列问题:
![]() 反应Ⅰ的
反应Ⅰ的![]() ______________。
______________。
![]() 在____
在____![]() 填“高温”或“低温”
填“高温”或“低温”![]() 情况下有利于反应Ⅱ的自发进行。
情况下有利于反应Ⅱ的自发进行。
![]() 氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以
氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在。
的形式存在。

![]() “溶浸”中 ZnO发生反应的离子方程式为 _______。
“溶浸”中 ZnO发生反应的离子方程式为 _______。
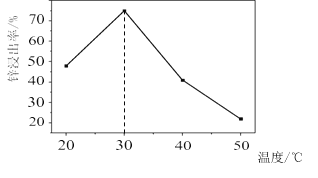
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析 ![]() 时锌浸出率最高的原因为 __________。
时锌浸出率最高的原因为 __________。
![]() “滤渣 3”的主要成分为_______________。
“滤渣 3”的主要成分为_______________。
【答案】![]() 高温
高温 ![]() 低于
低于![]() 时,溶浸反应速率随温度升高而增大;超过
时,溶浸反应速率随温度升高而增大;超过![]() ,氨气逸出导致溶浸反应速率下降
,氨气逸出导致溶浸反应速率下降 ![]() 、Cd
、Cd
【解析】
(1)![]() 依据热化学方程式和盖斯定律计算分析;
依据热化学方程式和盖斯定律计算分析;
![]() 依据反应自发进行的判断依据是△H-T△S<0分析;
依据反应自发进行的判断依据是△H-T△S<0分析;
![]() ①依据流程图可知,“溶浸”中ZnO发生反应生成
①依据流程图可知,“溶浸”中ZnO发生反应生成![]() ;
;
②低于![]() 时,浸出反应速率随温度的升高而增大;超过
时,浸出反应速率随温度的升高而增大;超过![]() 时,氨气逸出导致浸出反应速率下降;
时,氨气逸出导致浸出反应速率下降;
![]() 依据流程图可知,“滤渣3”的主要成分为锌发生置换反应的产物。
依据流程图可知,“滤渣3”的主要成分为锌发生置换反应的产物。
![]() 反应Ⅰ:2NH
反应Ⅰ:2NH![]() NH
NH![]() COONH
COONH![]() H1;
H1;
反应Ⅱ:NH![]() COONH
COONH![]()
![]() H2=+72.49KJ/mol;
H2=+72.49KJ/mol;
总反应:2NH3(g)+CO2(g)![]()
![]() H3=-86.98KJ/mol;根据盖斯定律,总反应
H3=-86.98KJ/mol;根据盖斯定律,总反应![]() 反应II,得到反应I,则H1=-86.98KJ/mol -(+72.49KJ/mol)=-159.47 KJ/mol;
反应II,得到反应I,则H1=-86.98KJ/mol -(+72.49KJ/mol)=-159.47 KJ/mol;
故答案为:-159.47 KJ/mol;
![]() 反应:NH
反应:NH![]() COONH
COONH![]()
![]() H2=+72.49KJ/mol,反应H>0,S>0,满足反应自发进行的判断依据是H-TS <0,则需要高温下反应自发进行;
H2=+72.49KJ/mol,反应H>0,S>0,满足反应自发进行的判断依据是H-TS <0,则需要高温下反应自发进行;
故答案为:高温。
![]() 依据流程图可知,“溶浸”中 ZnO发生反应的离子方程式为:
依据流程图可知,“溶浸”中 ZnO发生反应的离子方程式为:![]() ;
;
故答案为:![]() ;
;
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析![]() 时锌浸出率最高的原因为:低于
时锌浸出率最高的原因为:低于![]() 时,浸出反应速率随温度的升高而增大;超过
时,浸出反应速率随温度的升高而增大;超过![]() 时,氨气逸出导致浸出反应速率下降;
时,氨气逸出导致浸出反应速率下降;
故答案为:低于![]() 时,溶浸反应速率随温度升高而增大;超过
时,溶浸反应速率随温度升高而增大;超过![]() ,氨气逸出导致溶浸反应速率下降;
,氨气逸出导致溶浸反应速率下降;
![]() 依据流程图可知,“滤渣3”的主要成分为锌发生置换反应的产物,所以主要成分为:Cu、Cd;
依据流程图可知,“滤渣3”的主要成分为锌发生置换反应的产物,所以主要成分为:Cu、Cd;
故答案为:Cu、Cd。