题目内容
(2009?中山模拟)下列叙述正确的是( )
分析:A、等物质的量的小苏打和烧碱恰好反应生成碳酸钠溶液,根据电荷守恒判断溶液中离子浓度的关系.
B、该二元酸第一步完全电离,第二步部分电离,所以导致HA-只能电离不能水解.
C、氨水的浓度远远大于盐酸的浓度,等体积混合后,根据溶液的酸碱性判断各种离子浓度大小的关系.
D、常温下,pH=12的Ba(OH)2溶液中氢氧根离子的浓度是0.01mol/L,氢氧化钡的浓度是0.005mol/L,当溶液中的Ba2+、SO42-均恰好完全沉淀,氢氧化钡和硫酸的物质的量之比是1:1,发生的化学反应是Ba(OH)2+NaHSO4=BaSO4↓+NaHO+H2O,根据氢氧化钠的物质的量计算混合溶液的PH值.
B、该二元酸第一步完全电离,第二步部分电离,所以导致HA-只能电离不能水解.
C、氨水的浓度远远大于盐酸的浓度,等体积混合后,根据溶液的酸碱性判断各种离子浓度大小的关系.
D、常温下,pH=12的Ba(OH)2溶液中氢氧根离子的浓度是0.01mol/L,氢氧化钡的浓度是0.005mol/L,当溶液中的Ba2+、SO42-均恰好完全沉淀,氢氧化钡和硫酸的物质的量之比是1:1,发生的化学反应是Ba(OH)2+NaHSO4=BaSO4↓+NaHO+H2O,根据氢氧化钠的物质的量计算混合溶液的PH值.
解答:解:A、根据题意知,两种溶质的物质的量相等,碳酸氢钠和氢氧化钠恰好反应生成碳酸钠,溶液呈电中性,溶液中阴阳离子所带电荷相等,所以c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故A正确.
B、该二元酸第一步完全电离,第二步部分电离,HA-只能电离不能水解,所以NaHA溶液中没有H2A,NaHA溶液中:c(Na+)=c(A2-)+c(HA-),故B错误.
C、PH=2的盐酸溶液,盐酸的物质的量浓度是0.01mol/L,PH=12的氨水中,氨水的物质的量浓度远远大于0.01mol/L,所以PH=12的氨水与pH=2的盐酸等体积混合,氨水过量导致溶液呈碱性,溶液中铵根离子浓度大于氯离子浓度,氢氧根离子浓度大于氢离子浓度,所以c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误.
D、常温下,pH=12的Ba(OH)2溶液中氢氧根离子的浓度是0.01mol/L,当溶液中的Ba2+、SO42-均恰好完全沉淀,氢氧化钡和硫酸的物质的量之比是1:1,发生的化学反应是Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O,有一半的氢氧根离子没有参加反应,所以混合溶液中氢氧根离子的浓度是
=0.001mol/L,所以溶液的PH=11,故D正确.
故选AD.
B、该二元酸第一步完全电离,第二步部分电离,HA-只能电离不能水解,所以NaHA溶液中没有H2A,NaHA溶液中:c(Na+)=c(A2-)+c(HA-),故B错误.
C、PH=2的盐酸溶液,盐酸的物质的量浓度是0.01mol/L,PH=12的氨水中,氨水的物质的量浓度远远大于0.01mol/L,所以PH=12的氨水与pH=2的盐酸等体积混合,氨水过量导致溶液呈碱性,溶液中铵根离子浓度大于氯离子浓度,氢氧根离子浓度大于氢离子浓度,所以c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误.
D、常温下,pH=12的Ba(OH)2溶液中氢氧根离子的浓度是0.01mol/L,当溶液中的Ba2+、SO42-均恰好完全沉淀,氢氧化钡和硫酸的物质的量之比是1:1,发生的化学反应是Ba(OH)2+NaHSO4=BaSO4↓+NaOH+H2O,有一半的氢氧根离子没有参加反应,所以混合溶液中氢氧根离子的浓度是
0.01mol×
| ||
| 0.05L |
故选AD.
点评:本题考查了混合溶液中离子浓度大小的比较,难度较大,易错选项是B,注意该二元酸第一步是完全电离,第二步是部分电离,导致HA-只能电离不能水解.

练习册系列答案
相关题目
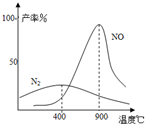 (2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下:
(2009?中山模拟)工业合成氨与制备硝酸一般可连续生产,流程如下: