题目内容
化学反应原理在工业生产中具有十分重要的意义.
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如图1:
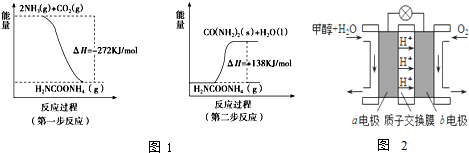
则NH3(g)与CO2(g)反应生成学科王尿素的热化学方程式为 .
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数K的表达式为 ,a 0(填“>”、“<”或“=”).在500℃2L密闭容器中进行反应,Fe和CO2的起始量均为4mol,则5min后达到平衡时CO2的转化率为 ,生成CO的平均速率v(CO)为 .
②700℃反应达到平衡后,要使反应速率增大且平衡向右移动,可采取的措施有 .
(3)利用CO与H2可直接合成甲醇,如图2是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH= (溶液电解前后体积的变化忽略不计).
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如图1:

则NH3(g)与CO2(g)反应生成学科王尿素的热化学方程式为
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ?mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度(℃) | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②700℃反应达到平衡后,要使反应速率增大且平衡向右移动,可采取的措施有
(3)利用CO与H2可直接合成甲醇,如图2是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式
考点:热化学方程式,原电池和电解池的工作原理,化学平衡的影响因素
专题:
分析:(1)由图示可知,两步反应的完成的热效应与一步完成的热效应是相同的;
(2)①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写反应①的平衡常数,注意固体不需要写出;由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,据此判断a值的符号;
令平衡时参加反应的二氧化碳的物质的量为xmol,利用三段式表示出平衡时各组分的物质的量,气体的化学计量数都为1,前后气体的物质的量相等,用物质的量代替浓度代入平衡常数计算x的值,再利用转化率定义计算二氧化碳的转化率;根据参加反应的二氧化碳的物质的量计算生成的CO的物质的量,再根据v=
计算v(CO);
②根据平衡移动原理进行分析解答;
(3)负极发生氧化反应,根据电子守恒求消耗的氢氧根离子浓度.
(2)①化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写反应①的平衡常数,注意固体不需要写出;由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,据此判断a值的符号;
令平衡时参加反应的二氧化碳的物质的量为xmol,利用三段式表示出平衡时各组分的物质的量,气体的化学计量数都为1,前后气体的物质的量相等,用物质的量代替浓度代入平衡常数计算x的值,再利用转化率定义计算二氧化碳的转化率;根据参加反应的二氧化碳的物质的量计算生成的CO的物质的量,再根据v=
| ||
| △t |
②根据平衡移动原理进行分析解答;
(3)负极发生氧化反应,根据电子守恒求消耗的氢氧根离子浓度.
解答:
解:(1)由图示可知,两步反应的完成的热效应与一步完成的热效应是相同的,将两个反应相加可得2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol,
故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol;
(2)①反应Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数k=
,
由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故a>0,
令平衡时参加反应的二氧化碳的物质的量为xmol,则:
Fe(s)+CO2(g)═FeO(s)+CO(g)
开始(mol):4 0
变化(mol):x x
平衡(mol):4-x x
所以
=1,解得x=2,
故二氧化碳的转化率为
×100%=50%,
故CO表示的平均速率v(CO)=
=0.2mol/(L?min)
故答案为:
;>;50%;0.2mol/(Lmin);
②根据该反应是气体体积不变的吸热反应,所以要使反应速率增大且平衡向右移动,可采取的措施是增加CO2的量或者升高温度,
故答案为:增加CO2的量或者升高温度;
(3)负极发生氧化反应,负极CH3OH-6e-+H2O=CO2+6H+,依据电子守4OH-~O2~4e-,当消耗560mLO2(标准状况下)时即
=0.025mol,依据电子守恒4OH-~O2~4e-,则消耗的氢氧根离子物质的量为0.025mol×4=0.1mol,所以溶液中氢离子的浓度为:
=0.1mol/L,故PH=1;故答案为:CH3OH-6e-+H2O=CO2+6H+;1.
故答案为:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(l)△H=-134 kJ/mol;
(2)①反应Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数k=
| c(CO) |
| c(CO 2) |
由表中数据可知,对于反应①,温度越高平衡常数越大,说明升高温度平衡向正反应移动,升高温度平衡向吸热反应进行,故a>0,
令平衡时参加反应的二氧化碳的物质的量为xmol,则:
Fe(s)+CO2(g)═FeO(s)+CO(g)
开始(mol):4 0
变化(mol):x x
平衡(mol):4-x x
所以
| x |
| 4-x |
故二氧化碳的转化率为
| 2mol |
| 4mol |
故CO表示的平均速率v(CO)=
| ||
| 5min |
故答案为:
| c(CO) |
| c(CO 2) |
②根据该反应是气体体积不变的吸热反应,所以要使反应速率增大且平衡向右移动,可采取的措施是增加CO2的量或者升高温度,
故答案为:增加CO2的量或者升高温度;
(3)负极发生氧化反应,负极CH3OH-6e-+H2O=CO2+6H+,依据电子守4OH-~O2~4e-,当消耗560mLO2(标准状况下)时即
| 0.56 |
| 22.4 |
| 0.1 |
| 1 |
点评:本题考查反应速率计算、平衡常数、化学平衡计算、影响反应速率与化学平衡移动的因素、盖斯定律与反应热的计算等,难度中等.

练习册系列答案
相关题目
N2O5是一种新型硝化剂,一定温度下,在恒压密闭容器中充入4mol NO2、1mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g)达到平衡时,N2O5的浓度为a mol?L-1;若保持其他条件不变,起始时向容器中充入8mol NO2、2mol O2,达到平衡时,N2O5的浓度为( )
A、
| ||
| B、a mol?L-1 | ||
| C、2a mol?L-1 | ||
| D、无法确定 |
下列关于原电池的叙述中,正确的是( )
| A、电子从负极经外电路流向正极 |
| B、在原电池中,负极上发生还原化反应 |
| C、原电池工作时,溶液中的阳离子向负极移动 |
| D、构成原电池的正极和负极必须是两种不同的金属 |
下列热化学方程式正确的是( )
| A、甲烷的燃烧热为890.3 kJ?mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ?mol-1 | |||
| B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为 N2(g)+3H2(g)
| |||
C、已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+
| |||
| D、25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ?mol-1,硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(l)△H=-114.6 kJ?mol-1 |
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大.已知:B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2.由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y,A与C形成的气态化合物Z在标准状况下的密度为0.76g/L,Z溶于水所得溶液为W.下列说法正确的是( )
| A、元素C在周期表中的位置是第三周期第ⅤA族 |
| B、在等体积、等pH的X、Y溶液中分别加入等质量的锌粉,充分反应后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X<Y |
| C、由A、B、C、D四种元素形成的化合物一定只有共价键 |
| D、25℃时,将W溶液与Y溶液等体积混合,充分反应后若pH=7则c(W)>c(Y) |
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A、X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B、由X、Y和氢三种元素形成的化合物中一定只有共价键 |
| C、W、X、Z三种元素最高价氧化物对应水化物的酸性逐渐减弱 |
| D、T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
下列离子方程式正确的是( )
| A、在碳酸氢钠溶液中加入过量的氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| B、向明矾溶液中加入少量的Ba(OH)2溶液:Al3++3OH-+Ba2++SO42-=BaSO4↓+Al(OH)3↓ |
| C、向Fe2(SO4)3溶液中加入过量的Na2S:2Fe3++S2-=2Fe2++S↓ |
| D、向含有1molFeBr2溶液中通入标准状况下22.4L的Cl2:2Br-+Cl2=Br2+2Cl- |
 卤代烃里的卤原子易与活泼金属阳离子结合,发生下列反应:
卤代烃里的卤原子易与活泼金属阳离子结合,发生下列反应: