题目内容
14.某液态烃A的分子式为C14H22,实验证明它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色.该烃分子的一个氢原子被溴原子取代,所得一溴代物有2种同分异构体,则该烃的结构简式为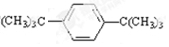 .
.
分析 液态烃A的分子式为C14H22,符合CnH2n-6,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,应为苯的同系物,烃分子的一个氢原子被溴原子取代,所得一溴代物有2种同分异构体,则结构对称、烃基、苯环各含有1个等效H原子,以此解答该题.
解答 解:液态烃A的分子式为C14H22,符合CnH2n-6,它能使酸性高锰酸钾溶液褪色,但不能使溴水褪色,应为苯的同系物,烃分子的一个氢原子被溴原子取代,所得一溴代物有2种同分异构体,则结构对称、烃基、苯环各含有1个等效H原子,结构简式应为 ,
,
故答案为: .
.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物结构的判断,难度不大.

练习册系列答案
相关题目
5.能正确表示下列反应的离子方程式的是( )
| A. | 石灰石跟盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与盐酸的反应OH-+H+═H2O | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ |
9.青蒿酸是合成青蒿素的原料,其结构如图所示.下列有关青蒿酸的说法正确的是( )
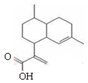

| A. | 青蒿素分子式为:C15H20O2 | |
| B. | 1 mol青蒿酸可与3 mol H2发生加成反应 | |
| C. | 在一定条件,可与乙醇发生酯化反应 | |
| D. | 能使溴水褪色,不能使酸性高锰酸钾溶液褪色 |
1.如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
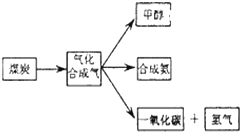
(1)已知该产业链中煤炭气化反应C(s)+H2O(g)═CO(g)+H2(g)的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$.
(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)此温度下,在恒容密闭容器中开始只加入CO、H2,反应l0min后达到平衡,测得各组分的浓度如下:
①该时间段内反应速率v(H2)=0.08mol/(L•min),
②反应达到平衡后,其它条件不变,能判断该反应达到化学平衡状态的标志是ac
a.体系压强不变
b.混合气体的密度不变
c.混合气体的平均摩尔质量不变
d.v正(H2)=v逆(CH3OH)
③已知在常温常压下:
a.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
b.2CO (g)+O2(g)═2CO2(g)△H2
c.H2O(g)═H2O(l)△H3
则2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l)△H=△H1-△H2+4△H3(用含△H 1、△H2、△H3 的式子表示)
(3)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为负极,正极反应的电极反应式为O2+2H2O+4e-=4OH-.

(1)已知该产业链中煤炭气化反应C(s)+H2O(g)═CO(g)+H2(g)的平衡常数表达式为:K=$\frac{c({H}_{2})•c(CO)}{c({H}_{2}O)}$.
(2)合成甲醇的主要反应是:2H2(g)+CO(g)?CH3OH(g)此温度下,在恒容密闭容器中开始只加入CO、H2,反应l0min后达到平衡,测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
②反应达到平衡后,其它条件不变,能判断该反应达到化学平衡状态的标志是ac
a.体系压强不变
b.混合气体的密度不变
c.混合气体的平均摩尔质量不变
d.v正(H2)=v逆(CH3OH)
③已知在常温常压下:
a.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
b.2CO (g)+O2(g)═2CO2(g)△H2
c.H2O(g)═H2O(l)△H3
则2CH3OH(l)+2O2(g)═2CO(g)+4H2O(l)△H=△H1-△H2+4△H3(用含△H 1、△H2、△H3 的式子表示)
(3)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池.则充入 CH3OH的电极为负极,正极反应的电极反应式为O2+2H2O+4e-=4OH-.
 .
. .
.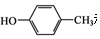 和CH3COOH为原料制备
和CH3COOH为原料制备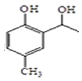 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).