题目内容
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,(1))请写出NO2和CO反应的热化学方程式:
已知:N2 (g)+2NO2 (g)?4NO(g)△H=+292.3kJ?mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| N(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
已知:K3000C>K3500C,则该反应是
考点:热化学方程式,用盖斯定律进行有关反应热的计算,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题
分析:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;然后根据盖斯定律来解答;
(2)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;温度低,化学平衡常数大,则正反应放热.
(2)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;温度低,化学平衡常数大,则正反应放热.
解答:
解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为:
NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1 ①
又有N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ?mol-1②
将2×①-②可得:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-760.3kJ/mol.
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;-760.3kJ/mol;
(2)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,即K=
;温度低,化学平衡常数大,则正反应放热,
故答案为:
;放热.
NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1 ①
又有N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ?mol-1②
将2×①-②可得:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-760.3kJ/mol.
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;-760.3kJ/mol;
(2)化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,即K=
| c2(N2O5) |
| c4(NO2)?c(O2) |
故答案为:
| c2(N2O5) |
| c4(NO2)?c(O2) |
点评:本题考查盖斯定律的应用、化学平衡常数表达式的书写和计算以及平衡的移动等知识,题目难度不大.

练习册系列答案
相关题目
向一由Fe、Cu组成的混合粉末中加入一定量的稀硝酸,充分反应后剩余金属X g,再各其中加入一定量的稀硫酸,充分振荡后余下金属Y g.则x和y之间的关系是( )
| A、X一定大于Y |
| B、X可能等于Y |
| C、X可能小于Y |
| D、X可能大于Y |
MgCl2溶液与Na2SO4溶液混和后,c(Mg2+)=c(SO42-),则下列说法不正确的是( )
| A、混和液中c(Cl-)=c(Na+) |
| B、混和液中c(Cl-)=2c(SO42-) |
| C、混和前两溶液体积相等 |
| D、混和前两溶液中MgCl2与Na2SO4物质的量相等 |
下列有关说法正确的是( )
| A、某反应2A (g)+B(g)═3C(s)在室温下可自发进行,则该反应的△H<0 | ||
| B、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | ||
C、CH3COOH 溶液加水稀释后,溶液中
| ||
| D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小 |
下列是有关实验的叙述,正确的是( )
| A、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| B、分别含有Mg2+、Cu2+和Na+的三种盐酸盐溶液,用NaOH溶液就能一次鉴别开 |
| C、加热氯化钠溶液得氯化钠固体,需用表面皿 |
| D、从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤:溶解→过滤→蒸馏 |
除去乙烷中混有少量乙烯的最好试剂是( )
| A、酸性KMnO4溶液 |
| B、催化剂加氢 |
| C、溴的四氯化碳溶液 |
| D、溴水 |
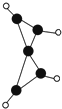 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法正确的是( )| A、充分燃烧等质量的X和甲烷,X消耗氧气较多 |
| B、X是一种常温下能稳定存在的液态烃 |
| C、X和乙烷类似,都容易发生取代反应 |
| D、X既能使溴的四氯化碳溶液褪色又能使酸性KMnO4溶液褪色 |
 氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答: