题目内容
现有部分前四周期元素的性质或原子结构如下表:
( 1)写出元素E基态原子的电子排布式: ,基态C原子的价电子轨道表示式是 。
(2)B单质分子中,含有 个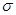 键和 个
键和 个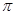 键。元素B的气态氢化的空间构型
键。元素B的气态氢化的空间构型
为 ,其中B原子的杂化方式是
(3)A、B、C第一电离由大到小的顺序为(用元素符号表示): ;
(4)将B的氢化物的水溶液逐滴加入到CuSO4溶液中直到过量,观察到的现象是 ,相关的离子方程式是 。
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材科 |
| B | L层s电子数比p电子数少l |
| C | 地壳中含量最高的元素 |
| D | 第三周期主族元素中其第一电离能最大 |
| E | 第四周期中未成对电子数最多 |
(2)B单质分子中,含有 个
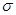 键和 个
键和 个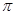 键。元素B的气态氢化的空间构型
键。元素B的气态氢化的空间构型为 ,其中B原子的杂化方式是
(3)A、B、C第一电离由大到小的顺序为(用元素符号表示): ;
(4)将B的氢化物的水溶液逐滴加入到CuSO4溶液中直到过量,观察到的现象是 ,相关的离子方程式是 。
(1)1s22s22p63s23p63d54s1或[Ar]3d54s1 ; 略
(2) 1 ;2 ;三角锥型 sp3 (3) N﹥O﹥Si
(4)开始生产蓝色沉淀,后又溶解;Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+ ;
Cu(OH)2+4 NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O
(2) 1 ;2 ;三角锥型 sp3 (3) N﹥O﹥Si
(4)开始生产蓝色沉淀,后又溶解;Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+ ;
Cu(OH)2+4 NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O
可推断出A、B、C、D、E五元素分别为:Si、N、O、Cl、Mn
本题整体较简单,需要指出的是在比较A、B、C第一电离能时要注意N原子的半充满状态。
本题整体较简单,需要指出的是在比较A、B、C第一电离能时要注意N原子的半充满状态。

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
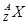 ,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求: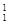 H、
H、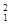 H、
H、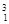 H、
H、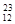 Mg、
Mg、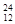 Mg和
Mg和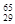 Cu中共有___ ___种元素,__ ____种原子。
Cu中共有___ ___种元素,__ ____种原子。