题目内容
2.将少量NH4HCO3粉末加入盐酸,反应剧烈,溶液温度降低,下列判断正确的是( )| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 溶液温度降低主要是因为NH4HCO3溶解吸热造成的 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl→NH4Cl+CO2↑+H2O-Q |
分析 溶液温度降低,则NH4HCO3与HCl的反应为吸热反应,说明反应物的总能量小于生成物的总能量,以此解答该题.
解答 解:A.因反应后溶液的温度降低,则NH4HCO3和盐酸的反应是吸热反应,故A错误;
B.溶液温度降低主要是因为复分解反应的吸热有关,故B错误;
C.为吸热反应,则反应物的总能量低于生成物的总能量,故C正确;
D.热化学方程式中应注明物质的状态,故D错误;
故选C.
点评 本题考查化学反应能量变化判断,为高频考点,侧重于学生的分析能力的考查,注意热化学方程式书写方法,选项B为解答的易错点,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
13.用括号中的试剂除去各组物质中的杂质,可选试剂不正确的是( )
| A. | 乙醇中的水(新制CaO) | B. | 乙烷中乙烯(溴水) | ||
| C. | 苯中的甲苯(溴水) | D. | 乙酸乙酯中的乙酸(饱和Na2CO3溶液) |
10.航天飞船用高氯酸铵固体作燃料,点燃时的反应:2NH4ClO4$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+4H2O+Cl2↑+2O2↑.下列对该反应的叙述中不正确的是( )
| A. | 该反应中反应物的总能量小于生成物的总能量 | |
| B. | 该反应属于分解反应、氧化还原反应、放出能量的反应 | |
| C. | 高氯酸铵是一种盐,属于离子化合物 | |
| D. | 在能量变化上,该反应主要是化学能转变为热能和动能 |
17.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水溶解;再加入足量氢氧化钠溶液(微热),产生白色沉淀并有气泡冒出.
②取少量样品加入足量稀盐酸有气泡产生,振荡后固体完全溶解.
该白色粉末可能为( )
①取少量样品加入足量水溶解;再加入足量氢氧化钠溶液(微热),产生白色沉淀并有气泡冒出.
②取少量样品加入足量稀盐酸有气泡产生,振荡后固体完全溶解.
该白色粉末可能为( )
| A. | NaHCO3、MgCl2 | B. | NH4HCO3、AlCl3 | C. | (NH4)2 CO3、BaCl2 | D. | NH4 HCO3、MgCl2 |
7.下列有机物中命名正确的是( )
| A. | 5-甲基-4一乙基己烷 | B. | 2,3-二甲基丁烷 | ||
| C. | 3,3-二甲基一4一乙基戊烷 | D. | 2,3,3-三甲基丁烷 |
14.X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是( )
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | Y的离子半径一定大于X的离子半径 | |
| C. | X与Y的简单离子不可能具有相同的电子层结构 | |
| D. | 两元素形成的化合物中,原子个数比不可能为1:1 |
11.下列有机物中不能发生银镜反应的是( )
| A. | 甲酸 | B. | 乙酸 | C. | 甲酸甲酯 | D. | 乙醛 |
2.溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-.某同学设计并完成了如图的实验:下列说法正确的是( )
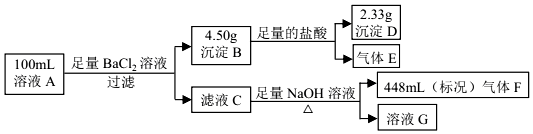

| A. | 溶液 A 中一定存在 NH4+、SO42-、SO32-,可能存在 Na+ | |
| B. | 溶液 A 中一定存在 NH4+、Mg2+、SO42-、SO32-,可能存在 Cl- | |
| C. | 溶液 A 中可能存在 Cl-,且 c(Na+)≥0.20 mol•L-1 | |
| D. | 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+ |