题目内容
氢氧燃料电池以KOH溶液为电解质溶液,下列有关该电池的叙述不正确的是( )
| A、正极反应式为:O2+2H2O+4e-═4OH- |
| B、工作一段时间后,电解液中KOH的物质的量浓度不变 |
| C、该燃料电池的总反应方程式为:2H2+O2═2H2O |
| D、氢氧燃料电池的能源利用率比氢气燃烧的能量利用率大 |
考点:常见化学电源的种类及其工作原理
专题:电化学专题
分析:氢氧燃料碱性电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,通入氧气的一极为电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,结合氧气和转移电子之间的关系式计算.
解答:
解:A.正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故A正确;
B.负极上氢气和氢氧根离子反应生成水,正极上氧气得电子和水反应生成氢氧根离子,所以溶液中钾离子没有参与反应,根据原子守恒知,KOH的物质的量不变浓度变大,故B错误;
C.负极电极反应式为H2-2e-+2OH-=2H2O,正极电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,故C正确;
D.氢氧燃料电池的能源利用率比氢气燃烧的能量利用率大,故D正确;
故选B.
B.负极上氢气和氢氧根离子反应生成水,正极上氧气得电子和水反应生成氢氧根离子,所以溶液中钾离子没有参与反应,根据原子守恒知,KOH的物质的量不变浓度变大,故B错误;
C.负极电极反应式为H2-2e-+2OH-=2H2O,正极电极反应式为O2+2H2O+4e-=4OH-,反应的总方程式为2H2+O2=2H2O,故C正确;
D.氢氧燃料电池的能源利用率比氢气燃烧的能量利用率大,故D正确;
故选B.
点评:本题考查了化学电源新型电池,根据正负极上得失电子确定电极,再结合电解质溶液酸碱性书写电极反应式,如果电解质溶液呈酸性,则正负极电极反应就改变,为易错点.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
用98%的浓硫酸(密度为1.84g?cm-3)配制80mL 1mol?L-1的稀硫酸用到的仪器有( )
①100mL量筒②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶⑥胶头滴管 ⑦玻璃棒⑧80mL容量瓶.
①100mL量筒②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶⑥胶头滴管 ⑦玻璃棒⑧80mL容量瓶.
| A、③④⑥⑦⑧ | B、②⑤⑥⑦ |
| C、①③⑥⑦⑧ | D、②③⑤⑥⑦ |
下列关于有机物的说法正确的是( )
| A、涤纶、纤维素、酚醛树脂都是合成材料 |
| B、汽油和植物油都是混合物,主要成份是烃和酯 |
| C、甲酸与乙酸是有机酸,都不能被酸性高锰酸钾溶液氧化 |
| D、葡萄糖、蔗糖、淀粉在一定条件下都可发生水解反应 |
少量铁粉与100ml0.01mol/L稀盐酸反应.为了加快速率而不改变H2产量,可以使用如下方法中的:①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加NaCl溶液 ⑤滴加几滴硫酸铜溶液 ⑥适当升高温度(不考虑盐酸挥发) ⑦改用10ml 0.1mol/L的盐酸( )
| A、③⑤⑥⑦ | B、③⑥⑦ |
| C、③④⑤⑥⑦ | D、①③⑤⑦ |
下列说法正确的是( )
| A、镀层破损后白铁(镀锌铁)比马口铁(镀锡铁)中的铁更易腐蚀 |
| B、SO2(g)+2H2S(g)═3S(s)+2H2O(l) 在常温下能自发进行,则该反应的△H>0 |
| C、0.1 mol?L-1CH3COOH溶液中加入少量水,CH3COOH电离程度和溶液pH均增大 |
| D、在N2+3H2?2NH3平衡体系中加入少量催化剂,反应速率和平衡常数均增大 |
如图有关电化学的示意图正确的是( )
A、 |
B、 |
C、 |
D、 |
下列反应中,不属于氧化还原反应的是( )
A、2 H2O2
| ||||
B、2 Al(OH)3
| ||||
C、Fe2O3+3 CO
| ||||
| D、Cl2+2 NaOH═NaCl+NaClO+H2O |
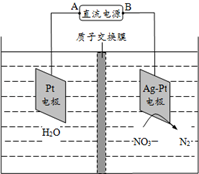 化学市场应用于环境保护.硝酸盐在消化道中可被还原成亚硝酸盐,亚硝酸盐可将低铁红蛋白氧化成高铁红蛋白,使之失去输氧能力,亚硝酸盐还可与仲胺类化合物反应生成亚硝胺类的致癌物质.长期饮用含高浓度硝酸盐的水,会使人畜中毒.目前关于硝酸盐危害的报道主要是“蓝婴儿综合征”.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示:
化学市场应用于环境保护.硝酸盐在消化道中可被还原成亚硝酸盐,亚硝酸盐可将低铁红蛋白氧化成高铁红蛋白,使之失去输氧能力,亚硝酸盐还可与仲胺类化合物反应生成亚硝胺类的致癌物质.长期饮用含高浓度硝酸盐的水,会使人畜中毒.目前关于硝酸盐危害的报道主要是“蓝婴儿综合征”.催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示: