题目内容
6.4g D2和20g 18O2化合时最多能生成22g D218O,1molD218O中含12mol中子.分析 发生反应:2D2+18O2=2D218O,进行过量计算,根据不足量的物质计算生成D218O的质量,每个D218O分子含有中子数为(1×2+18-8)=12,含有中子物质的量为D218O的12倍.
解答 解:由2D2+18O2=2D218O,可知4g D2完全反应需要 18O2的质量为4g×$\frac{36}{8}$=18g<20g,故4g D2完全反应,则生成 D218O的质量为4g×$\frac{2×22}{2×4}$=22g,
每个D218O分子含有中子数为(1×2+18-8)=12,含有中子物质的量为1mol×12=12mol,
故答案为:22;12.
点评 本题考查化学方程式有关计算、微粒数目计算等,注意题目中元素原子的质量数与中子数.

练习册系列答案
相关题目
14.某化学科研小组对周围大气进行监测,发现该地区首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的pH=4.
(2)①为减少SO2的排放,可洗涤含SO2的烟气,作为洗涤剂下列物质最好选择a(填字母).
a. 氨水 b. Na2CO3 c.O2 d.NaHSO3
②浓度均为0.1mol/L (NH4)2Fe(SO4)2、NH4HSO4、(NH4)2SO3,其中c(NH4+)最大的是(NH4)2Fe(SO4)2(填化学式).
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)═2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据①②△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)①为减少SO2的排放,可洗涤含SO2的烟气,作为洗涤剂下列物质最好选择a(填字母).
a. 氨水 b. Na2CO3 c.O2 d.NaHSO3
②浓度均为0.1mol/L (NH4)2Fe(SO4)2、NH4HSO4、(NH4)2SO3,其中c(NH4+)最大的是(NH4)2Fe(SO4)2(填化学式).
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)═2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据①②△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
1.当燃烧8.96升由CH4、CO、C2H6组成的混和气体时,除生成水外,还生成17.92升CO2气体(气体体积均在标准状况下测定).则原混和气体中含C2H6的物质的量是( )
| A. | 0.2mol | B. | 0.4 mol | C. | 0.6 mol | D. | 0.8 mol |
11.下列有关物质用途说法正确的是( )
| A. | 加热金属钠与氧气制取氧化钠 | B. | 用二氧化硫漂白粉丝、银耳 | ||
| C. | 晶体硅是良好的半导体材料 | D. | S可用于一步制取SO3 |
18.下列实验操作正确的是( )
| A. | 将氢氧化钠固体放在滤纸上称量 | |
| B. | 用10 mL量筒量取8.58 mL蒸馏水 | |
| C. | 用强光照射鉴别淀粉胶体与碳酸钠两种无色液体 | |
| D. | 蒸馏时,应将温度计的水银球插入液面以下 |
15.为达到预期的实验目的,下列操作正确的是( )
| A. | 向无色溶液中加BaCl2溶液,生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO${\;}_{4}^{2-}$ | |
| B. | 用pH试纸测定氯水的pH | |
| C. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 | |
| D. | 为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 |

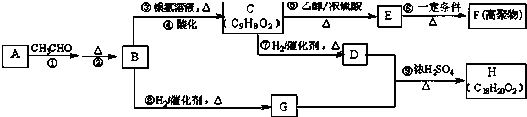
 .
. +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O
 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$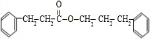 +H2O.
+H2O. .
.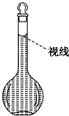 实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配置0.50mol/L NaCl溶液500mL.按下列操作步骤填上适当的文字,以使整个操作完整.