题目内容
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑,则下列判断不正确的是( )
| A、若氧化产物比还原产物多0.35mol,有0.050molKNO3被还原 |
| B、若氧化产物比还原产物多0.35mol,生成8.96LN2(标准状况) |
| C、若有0.2mol氧化剂反应,则转移电子的物质的量为2.0mol |
| D、KNO3的氧化性强于N2 |
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:10NaN3+2KNO3═K2O+5Na2O+16N2↑中,N元素的化合价由-
升高为0,N元素的化合价由+5价降低为0,以此来解答.
| 1 |
| 3 |
解答:
解:N元素的化合价由-
升高为0,N元素的化合价由+5价降低为0,所以NaN3是还原剂,KNO3是氧化剂,氮气既是氧化产物也是还原产物,且氧化产物与还原产物的物质的量之比为30:2=15:1,
A.由N原子守恒及元素的化合价变化可知,氧化产物比还原产物多14mol时,有2molKNO3被还原,则若氧化产物比还原产物多0.35mol,有0.35mol×
=0.050molKNO3被还原,故A正确;
B.由N原子守恒及元素的化合价变化可知,氧化产物比还原产物多14mol时,生成16mol气体,则氧化产物比还原产物多0.35mol,生成0.35mol×
×22.4L/mol=8.96,故B正确;
C.若有0.2mol氧化剂反应,则转移电子的物质的量为0.2mol×(5-0)=1.0mol,故C错误;
D.KNO3是氧化剂,由氧化剂的氧化性大于氧化产物的氧化性可知,KNO3的氧化性强于N2,故D正确;
故选C.
| 1 |
| 3 |
A.由N原子守恒及元素的化合价变化可知,氧化产物比还原产物多14mol时,有2molKNO3被还原,则若氧化产物比还原产物多0.35mol,有0.35mol×
| 2 |
| 14 |
B.由N原子守恒及元素的化合价变化可知,氧化产物比还原产物多14mol时,生成16mol气体,则氧化产物比还原产物多0.35mol,生成0.35mol×
| 16 |
| 14 |
C.若有0.2mol氧化剂反应,则转移电子的物质的量为0.2mol×(5-0)=1.0mol,故C错误;
D.KNO3是氧化剂,由氧化剂的氧化性大于氧化产物的氧化性可知,KNO3的氧化性强于N2,故D正确;
故选C.
点评:本题考查氧化还原反应,为高频考点,把握元素化合价变化及各个物理量之间的关系式为解答的关键,注意氧化产物和还原产物的物质的量之比为易错点,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是( )

| A、燃料电池工作时,正极反应为:O2+2H2O+4e-═4OH- |
| B、在溶液中SO42-往b极移动 |
| C、若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
| D、若a极是铜,b极是铁时,a极逐渐溶解,b极上有铜析出 |
下列除杂试剂或操作方法正确的一组是( )
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | KNO3溶液 | KOH | 加入FeCl3溶液,过滤 |
| ② | FeSO4溶液 | CuSO4 | 加入过量Fe粉,过滤 |
| ③ | H2 | CO2 | 通过盛NaOH溶液洗气瓶,再通过盛H2SO4洗气瓶 |
| ④ | NaNO3 | CaCO3 | 溶解,过滤,蒸发 |
| ⑤ | NaCl | KNO3 | 溶解,加热浓缩,冷却结晶,过滤 |
| A、②③④ | B、①②③④ |
| C、③④⑤ | D、②③⑤ |
下列关于化工生产原理的叙述中,符合目前工业生产实际的是( )
| A、氯碱工业中,离子交换膜的作用是防止离子运动 |
| B、硫酸、硝酸、合成氨均使用了催化剂 |
| C、石油裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
| D、氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸 |
下列说法正确的是( )
| A、pH试纸使用时要先湿润试纸,再用玻璃棒蘸取待测液点试纸,半分钟内与比色卡对照 | ||
| B、pH=5的盐酸加水稀释1000倍后PH=8 | ||
| C、pH=6的溶液一定是酸性溶液 | ||
D、某溶液C(H+)=KW
|
做铝的性质实验时,不能用于除去铝表面氧化膜的是( )
| A、砂纸打磨 |
| B、泡在烧碱溶液里 |
| C、泡在盐酸里 |
| D、泡在热水里 |
下列关于干冰转化为二氧化碳气体的过程判断正确的是( )
| A、△H>0,△S<0 |
| B、△H<0,△S>0 |
| C、△H>0,△S>0 |
| D、△H<0,△S<0 |
“绿色化学”又称环境无害化学、环境友好化学、清洁化学,某化学课外小组利用废铜制取硫酸铜,设计了如下制取方案,其中符合“绿色化学”要求的是( )
A、Cu
| ||||||
B、Cu
| ||||||
C、Cu
| ||||||
D、Cu
|
下列反应中,属于取代反应的是( )
A、CH4+2O2
| |||
B、ClCH2CH3+NaOH
| |||
C、CH3CH═CH2+Cl2
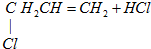 | |||
D、CH2═CH2+HCl
|