题目内容
11.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 54 g Al分别与足量的稀硫酸及氢氧化钠溶液反应失去的电子数都是6NA | |
| B. | 同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 | |
| C. | 1 mol•L-1的MgCl2溶液中,含有Cl-个数为2NA | |
| D. | 11.2 L氧气中所含有的原子数为NA |
分析 A、求出铝的物质的量,然后根据反应后铝元素为+3价来分析;
B、NA个NO2与NA个N2和O2的混合物的物质的量均为1mol;
C、溶液体积不明确;
D、氧气所处的状态不明确.
解答 解:A、54g铝的物质的量为2mol,而反应后铝元素为+3价,故2mol铝失去6mol电子即6NA个,故A正确;
B、NA个NO2与NA个N2和O2的混合物的物质的量均为1mol,故在同温同压下,气体的体积相同,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、氧气所处的状态不明确,故氧气的物质的量无法计算,则含有的氧原子的个数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 0.5molAl与足量盐酸反应转移电子数为1NA | |
| B. | 标准状况下,22.4L氨气与22.4L氮气所含原子数均为2NA | |
| C. | 7.8gNa2O2所含的离子数为0.3NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5NA |
2.下列叙述正确的是( )
| A. | 某溶液的pH<7,说明该溶液一定呈酸性 | |
| B. | 常温时pH=3的盐酸溶液与pH=5盐酸溶液等体积混合后溶液的pH=4 | |
| C. | 0.2 mol•L-1的盐酸,与等体积水混合后pH=1 | |
| D. | 常温时pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7 |
6.在汽车尾气处理装置中加入某种催化剂,发生如下反应:4CO+2NO2═4CO2+N2.下列对该反应的说法中错误的是( )
| A. | 该反应中氧化剂是CO、还原剂是NO2 | |
| B. | 该反应是氧化还原反应 | |
| C. | 该反应生成28 g N2时,转移8 mol e- | |
| D. | 该反应能减少汽车尾气对环境的污染 |
3.轨道表示式是表示原子核外电子运动状态的一种化学用语,下列有关原子的最外层的轨道表示式正确的是( )
| A. | 铍原子 | B. | 碳原子 | ||
| C. | 氯原子 | D. | 铝原子 |
20.25℃时,三种酸的电离平衡常数如下:
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c(填序号).
a.CO32-b.ClO-c.CH3COO-d.HCO3-
(2)下列反应不能发生的是c、d(填序号).
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2CO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是b(填序号).
a.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ b.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ c.$\frac{c({H}^{+})}{{K}_{W}}$ d.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图1,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”,下同)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+).
(5)向20mL硫酸和盐酸的混合液中,逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图2所示.
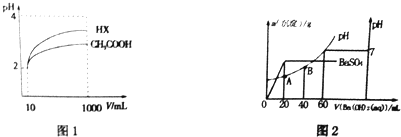
计算:①原混合溶液中c(H+)=0.3mol•L-1;c(Cl-)=0.2mol•L-1;
②A点的pH=1.
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
(1)下列四种离子结合质子的能力由大到小的顺序是a>b>d>c(填序号).
a.CO32-b.ClO-c.CH3COO-d.HCO3-
(2)下列反应不能发生的是c、d(填序号).
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2CO-
d.2ClO-+CO2+H2O=CO32-+2HClO
(3)用蒸馏水稀释0.10mol•L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是b(填序号).
a.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$ b.$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ c.$\frac{c({H}^{+})}{{K}_{W}}$ d.$\frac{c({H}^{+})}{c(O{H}^{-})}$
(4)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图1,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”,下同)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)大于醋酸溶液中水电离出来的c(H+).
(5)向20mL硫酸和盐酸的混合液中,逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成沉淀的质量变化及由此而引起的溶液的pH的变化如图2所示.

计算:①原混合溶液中c(H+)=0.3mol•L-1;c(Cl-)=0.2mol•L-1;
②A点的pH=1.
1.关于酶的说法中不正确的是( )
| A. | 酶是蛋白质 | B. | 酶是激素 | ||
| C. | 酶是催化剂 | D. | 酶是高分子化合物 |
 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.