题目内容
7.将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB═cC(固)+dD,当反应进行一段时间后,测得A减少了nmol,B减少n/2mol,C增加了3n/2mol,D增加了nmol,此时反应达到平衡.
(1)该反应方程式中,各物质的系数分别为:a=2,b=1,c=3,d=2
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:A气态,B液体或固体,D气态.
分析 (1)参加反应的各物质的物质的量变化与化学计量数成正比,可计算出该反应中的各计量数;
(2)只改变压强,反应速率发生变化,但平衡不发生移动,说明反应物、生成物气体的计量数之和相等;
解答 解:(1)同一化学反应的同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,所以a:b:c:d=n mol:$\frac{n}{2}$mol:$\frac{3}{2}n$mol:n mol=2:1:3:2,
故答案为:2;1;3;2;
(2)压强对化学反应前后气体体积不变的可逆反应的平衡状态无影响,根据题意知,该反应前后气体体积不变;
2A+B?3 C+2D,已知生成物C是固体,要使反应前后气体体积不变即计量数不变,那么只能是A、D是气体,B是液体或固体.
故答案为:气态;液体或固体;气态.
点评 本题考查了化学平衡的建立过程,为高频考点,题目难度中等,注意掌握化学平衡、化学反应速率的影响因素,明确化学计量数与参与反应的各物质的物质的量之间关系.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| B. | 除去SO2中少量HCl,将其通入饱和的Na2SO3溶液 | |
| C. | 在饱和氯水中Na+、K+、Cl-、CO32-能大量存在 | |
| D. | 向Ba(HCO3)2溶液中加入过量KOH溶液发生反应的离子方程式为:Ba2++HCO3-+OH-=BaCO3↓+H2O |
3.有机物A是某种药物的中间体,其结构简式为: ,关于有机物A的说法不正确的是( )
,关于有机物A的说法不正确的是( )
 ,关于有机物A的说法不正确的是( )
,关于有机物A的说法不正确的是( )| A. | A的分子式为C16H14O3 | |
| B. | A可使酸性KMnO4溶液和溴水褪色 | |
| C. | A苯环上的一氯代物同分异构体有2种 | |
| D. | A既可发生氧化反应和加成反应,也可以发生取代反应 |
2.同分异构现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是( )
①CH2=CHCH3②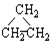 ③CH3CH2CH3 ④HC≡C-CH3.
③CH3CH2CH3 ④HC≡C-CH3.
①CH2=CHCH3②
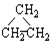 ③CH3CH2CH3 ④HC≡C-CH3.
③CH3CH2CH3 ④HC≡C-CH3.| A. | ①和② | B. | ①和③ | C. | ①和④ | D. | ②和④ |
19.下列与实验相关的叙述正确的是( )
| A. | 分散质粒子半径介于1nm~100nm之间的分散系称为胶体 | |
| B. | 胶体粒子很小,可以稳定存在的原因是胶粒的布朗运动 | |
| C. | 容量瓶用蒸馏水洗涤后残留有少量的水,将导致配制结果不变 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCL2溶液和稀盐酸 |
16.在水溶液中能大量共存的一组离子是( )
| A. | Na+、Ba2+、Cl-、NO3- | B. | Ba2+、Hg2+、S2-、SO42- | ||
| C. | NH4+、H+、CO32-、PO43- | D. | Ca2+、Al3+、Br-、CO32- |