题目内容
7.某溶液中含有0.005mol FeBr2及其他物质,向该溶液中通入134.4mL(标准状况)Cl2,溶液中只有FeBr2与Cl2反应,则通入Cl2后溶液中可能大量存在的离子是( )| A. | Fe2+、Fe3+、Br-、NO3- | B. | Fe2+、H+、NO3-、K+ | ||
| C. | Fe3+、Br-、NO3-、Cl- | D. | Fe2+、Br-、NO3-、Cl- |
分析 n(Cl2)=$\frac{0.1344L}{22.4L/mol}$=0.006mol,得电子为0.006mol×2×(1-0)=0.012mol,还原性Fe2+>Br-,0.005molFeBr2失去电子为0.005×(3-2)+0.005×2×(1-0)=0.015mol,所以溴离子还有剩余,结合选项中的离子不能发生反应来解答.
解答 解:n(Cl2)=$\frac{0.1344L}{22.4L/mol}$=0.006mol,得电子为0.006mol×2×(1-0)=0.012mol,还原性Fe2+>Br-,0.005molFeBr2失去电子为0.005×(3-2)+0.005×2×(1-0)=0.015mol,所以溴离子还有剩余,
A.由上述分析可知,亚铁离子全部被氧化,则溶液中不存在Fe2+,故A错误;
B.由上述分析可知,溶液中不存在Fe2+,且Fe2+、H+、N03-、发生氧化还原反应,不能共存,故B错误;
C.由上述分析可知,存在铁离子,溴离子、氯离子,且该组离子之间不反应,能共存,故C正确;
D.由上述分析可知,亚铁离子全部被氧化,则溶液中不存在Fe2+,故D错误.
故选C.
点评 本题考查离子的共存,明确离子的还原性强弱及电子守恒确定亚铁离子全被氧化,而溴离子部分被氧化为解答的难点,也是解答的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.已知常温下几种酸的电离常数如表所示:
(1)写出铬酸的第二步电离的K2表达式:$\frac{[Cr{{O}_{4}}^{-}]•[{H}^{+}]}{[HCr{{O}_{4}}^{-}]}$.
(2)常温下,KCN的水解常数Kh为2.0×10-5.
(3)常温下,浓度相同的K2S、K2SO3、K2CrO4三种水溶液中,水电离程度最大的是K2S.
(4)常温下,0.1mol•L-1氢硫酸溶液中离子浓度大小排序为H+>HS->S2+>OH-,.
(5)H2SO3第二步电离常数小于第一步电离常数,其主要原因是H2SO3第一步电离产生的氢离子会抑制第二步电离.
(6)已知常温下,Ksp(Ag2CrO4)=1.12×10-12,Ksp(BaCrO4)=1.17×10-10.在浓度都为0.001mol•L-1的含Ag+、Ba2+的溶液中,缓慢滴加稀K2CrO4溶液,先产生的沉淀的化学式是BaCrO4.
| 酸的化学式 电离常数K | 氢硫酸 H2S | 亚硫酸 H2SO3 | 铬酸 H2CrO4 | 氰酸 HCN |
| K1 | 9.1×10-8 | 1.5×10-2 | 1.8×10-1 | 5.0×10-10 |
| K2 | 1.1×10-12 | 1.0×10-7 | 3.2×10-7 |
(2)常温下,KCN的水解常数Kh为2.0×10-5.
(3)常温下,浓度相同的K2S、K2SO3、K2CrO4三种水溶液中,水电离程度最大的是K2S.
(4)常温下,0.1mol•L-1氢硫酸溶液中离子浓度大小排序为H+>HS->S2+>OH-,.
(5)H2SO3第二步电离常数小于第一步电离常数,其主要原因是H2SO3第一步电离产生的氢离子会抑制第二步电离.
(6)已知常温下,Ksp(Ag2CrO4)=1.12×10-12,Ksp(BaCrO4)=1.17×10-10.在浓度都为0.001mol•L-1的含Ag+、Ba2+的溶液中,缓慢滴加稀K2CrO4溶液,先产生的沉淀的化学式是BaCrO4.
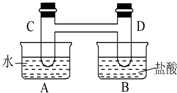 如图所示,在容器A中装有20℃的水50mL,容器B中装有1 mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:
如图所示,在容器A中装有20℃的水50mL,容器B中装有1 mol/L的盐酸50mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡: 已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量.
已知常温下甲醛是一种无色、有刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确认的致癌物和致畸物质之一.我国规定:居室中甲醛含量不得超过0.08mg/m3.可利用酸性高锰酸钾溶液测定甲醛含量. .
.
 .
. .
.