��Ŀ����
����Ŀ��Ԫ�ظ���Cr������Һ����Ҫ��Cr3+������ɫ����Cr��OH��4������ɫ����Cr2O72�����Ⱥ�ɫ����CrO42������ɫ������ʽ���ڣ�Cr��OH��3Ϊ������ˮ�Ļ���ɫ���壬�ش�
��1��Cr3+��Al3+�Ļ�ѧ�������ƣ���Cr2��SO4��3��Һ�е���NaOH��Һֱ���������ɹ۲쵽�������� ��
��2��CrO42����Cr2O72������Һ�п��ת���������£���ʼŨ��Ϊ1.0molL��1��Na2CrO4��Һ��c��Cr2O72������c��H+���ı仯��ͼ��ʾ�� 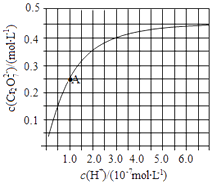
�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ ��
����ͼ��֪����Һ������ǿ��CrO42����ƽ��ת�����������С�����䡱����
����A�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ ��
��3����K2CrO4Ϊָʾ������AgNO3��Һ�ζ���Һ�е�Cl�� �� Ag+��CrO42������ש��ɫ����ʱ����ζ��յ㣮����Һ��Cl��ǡ����ȫ������Ũ�ȵ���1.0��10��5molL��1��ʱ����Һ��c ��Ag+��ΪmolL��1 �� ��ʱ��Һ��c��CrO42��������molL��1 �� ��Ksp��Ag2CrO4��=2.0��10��12��Ksp��AgCl��=2.0��10��10����
��4��+6�۸��Ļ����ﶾ�Խϴ���NaHSO3����Һ�е�Cr2O72����ԭ��Cr3+ �� ��Ӧ�����ӷ���ʽΪ ��
���𰸡�
��1����Һ����ɫ��dz��ͬʱ��������ɫ������Ȼ��������ܽ��γ���ɫ��Һ
��2��2CrO42��+2H+?Cr2O72��+H2O������1.0��1014
��3��2.0��10��5��5.0��10��3
��4��Cr2O72��+3HSO3��+5H+=2Cr3++3SO42��+4H2O
���������⣺��1��Cr3+��Al3+�Ļ�ѧ�������ƣ���֪Cr��OH��3Ϊ��������������ܽ�������������Һ�У���Cr2��SO4��3��Һ�е���NaOH��Һֱ��������������Cr��OH��3����ɫ��������������NaOH������ܽ⣬������ɫCr��OH��4�������Դ��ǣ���Һ����ɫ��dz��ͬʱ��������ɫ������Ȼ��������ܽ��γ���ɫ��Һ����2����CrO42����Cr2O72������Һ��ת�������ӷ���ʽΪ��2CrO42��+2H+Cr2O72��+H2O��
���Դ��ǣ�2CrO42��+2H+Cr2O72��+H2O������Һ��������ƽ��2CrO42��+2H+Cr2O72��+H2O������У�CrO42����ƽ��ת��������A��Cr2O72����Ũ��Ϊ0.25mol/L�������ĵ�CrO42����Ũ��Ϊ0.5mol/L������Һ�е�c��CrO42����=1.0mol/L��0.25mol/L��2=0.5mol/L��H+Ũ��Ϊ1��10��7mol/L����ʱ��ת����Ӧ��ƽ�ⳣ��ΪK= ![]() =
= ![]() =1.0��1014��
=1.0��1014��
���Դ��ǣ�����1.0��1014����3������Һ��Cl����ȫ����ʱ����c��Cl����=1.0��10��5mol/L������Ksp��AgCl��=2.0��10��10 �� ����õ�c��Ag+��= ![]() =
= ![]() =2.0��10��5����ʱ��Һ��c��CrO42����=
=2.0��10��5����ʱ��Һ��c��CrO42����= ![]() =
= ![]() =5.0��10��3��
=5.0��10��3��
���Դ��ǣ�2.0��10��5�� 5.0��10��3����4��NaHSO3�Ļ�ԭ�Խ���Һ�е�Cr2O72����ԭ��Cr3+ �� HSO3��������ΪSO42�� �� ��Ӧ�����ӷ���ʽΪ��
Cr2O72��+3HSO3��+5H+=2Cr3++3SO42��+4H2O��
���Դ��ǣ�Cr2O72��+3HSO3��+5H+=2Cr3++3SO42��+4H2O��
�����㾫�������û�ѧƽ��ļ������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

����Ŀ����������Ϊһ�����ʹ��ܵ�أ���Ӧ���õ����Ӻͷ�չ��
��1��Al��NO3��3���Ʊ������ز�����ԭ��֮һ������Al��NO3��3�������ջ����е�ˮ�֣������Ҫ������ж������������岽����ͼ��ʾ�� 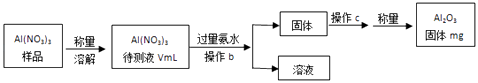
�ټ��������ˮ������Ӧ�����ӷ���ʽΪ�� ��
�ڲ���bΪ��
��Al��NO3��3����Һ�У�c��Al3+��=mol/L���ú�m��V�Ĵ���ʽ��ʾ����
��2�������������ڽ����ơ�������Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ�����Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ��䷴Ӧԭ����ͼ1��ʾ�� 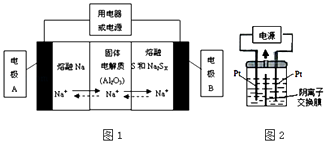
���� | Na | S | Al2O3 |
�۵�/�� | 97.8 | 115 | 2050�� |
�е�/�� | 892 | 444.6 | 2980 |
�ٸ��ݱ����ݣ������жϸõ�ع���������Ӧ������������ĸ����Χ�ڣ�
A.100������ B.100��300��C.300��350��D.350��2050��
�ڷŵ�ʱ���缫AΪ�����缫B������Ӧ���������ԭ����
�۳��ʱ���ܷ�ӦΪNa2SX�T2Na+xS��3��x��5�����������ĵ缫��ӦʽΪ�� ��
��3��������������Ϊ��Դ��������װ��KI��������Һ��ͼ2��ʾ�����ڵ��м��������ӽ���Ĥ������ͨ��һ��ʱ����������Һ����ɫ��һ��ʱ�����ɫ��dz�����Ҳ���ĵ缫����ʽ�����Է��������Һ��ɫ��dz�Ŀ���ԭ���ǣ� ��
����Ŀ��һ�������£�ͨ�����з�Ӧ�����Ʊ������մɵ�ԭ��MgO��
MgSO4��s��+CO��g��MgO��s��+CO2��g��+SO2��g����H��0
�÷�Ӧ�ں��ݵ��ܱ������дﵽƽ��������ı�ͼ�к�����x��ֵ�����´ﵽƽ���������y��x�仯���ƺ������ǣ� ��
ѡ�� | x | y |
A | �¶� | �����ڻ��������ܶ� |
B | CO�����ʵ��� | CO2��CO�����ʵ���֮�� |
C | SO2��Ũ�� | ƽ�ⳣ��K |
D | MgSO4����������������� | CO��ת���� |
A.A
B.B
C.C
D.D
����Ŀ����50mL 0.50molL��1������50mL 0.55molL��1 NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ���ⶨǿ����ǿ�Ӧ�ķ�Ӧ�ȣ� 
��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �¶Ȳ� | |||
HCl | NaOH | ƽ��ֵ | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
��1���ڸ�ʵ���У���ȡ50mL�����NaOH��Һ����Ҫ�õ��IJ���������
��2��װ���д�С�ձ�֮����������ĭ���ϵ�Ŀ������
��3��ijͬѧʵ���¼���������ϱ���ʾ�����м�¼����ֹ�¶���ָ�¶ȣ�
��4�������ʵ�鷢���кͷ�Ӧʱ�ų�������ΪkJ[�кͺ����ɵ���Һ�ı�����c=4.18J��g�棩��1 �� ϡ��Һ���ܶȶ�Ϊ1gcm��3]��
��5�������50mL 0.55mol/L�İ�ˮ��NH3H2O������NaOH��Һ��������ʵ�飬ͨ����õķ�Ӧ�ȼ����к��ȣ����к��ȡ�H��ƫ����ԭ���� ��