题目内容
【题目】在1LK2SO4和CuSO4的混合溶液中,C(SO42﹣)=2molL﹣1 , 用石墨作电极电解该溶液,当通电一段时间后,两极均收集到22.4L(标况)气体,则原溶液中k+的物质的量浓度为( )
A.2molL﹣1
B.3 molL﹣1
C.1molL﹣1
D.0.5 molL﹣1
【答案】A
【解析】解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)= ![]() =1mol,则阴极放出氢气也为1mol,
=1mol,则阴极放出氢气也为1mol,
阳极发生电极反应为:4OH﹣﹣4e﹣═O2↑+2H2O,
4mol 4mol 1mol
阴极发生的电极反应为:Cu2++2e﹣═Cu、2H++2e﹣═H2↑
1mol 2mol 1mol 2mol 2mol 1mol
c(Cu2+)= ![]() =1mol/L,由电荷守恒可知,原混合溶液中c(K+)为2mol/L×2﹣1mol/L×2=2mol/L,故A正确.
=1mol/L,由电荷守恒可知,原混合溶液中c(K+)为2mol/L×2﹣1mol/L×2=2mol/L,故A正确.
故选A.

 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
选项 | x | y |
A | MgSO4的质量(忽略体积) | CO的转化率 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | 温度 | 容器内混合气体的密度 |

A.A
B.B
C.C
D.D
【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热. 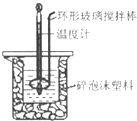
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为kJ[中和后生成的溶液的比热容c=4.18J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)如果用50mL 0.55mol/L的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 .