题目内容
3.关于Na2CO3和NaHCO3的性质,有关叙述正确的是( )| A. | 在水中溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3<NaHCO3 | |
| C. | 与酸反应的速度:Na2CO3>NaHCO3 | |
| D. | Na2CO3不能转化成NaHCO3,而NaHCO3能转化为Na2CO3 |
分析 A.相同条件下,碳酸钠的溶解度大;
B.碳酸氢钠受热易分解;
C.碳酸氢钠与盐酸反应一步完成,而碳酸钠与盐酸反应两步进行;
D.碳酸钠溶液通入二氧化碳生成碳酸氢钠,碳酸氢钠加热或与氢氧化钠反应生成碳酸钠.
解答 解:A.常温下,向饱和碳酸钠溶液中通入二氧化碳气体,有碳酸氢钠晶体析出,可知常温时水溶解性:Na2CO3>NaHCO3,故A正确;
B.NaHCO3不稳定,加热易分解:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,对热稳定性:Na2CO3>NaHCO3,故B错误;
C.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故C错误;
D.碳酸钠和二氧化碳反应生成碳酸氢钠,碳酸氢钠也可以加热分解生成碳酸钠,反应的条件不同,不是可逆反应,故D错误;
故选A.
点评 本题考查Na2CO3和NaHCO3性质的异同,为高频考点,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.

练习册系列答案
相关题目
14.下列物质中既有有离子键又有共价键的是( )
| A. | Na2S | B. | NaCl | C. | Na2O2 | D. | BaCl2 |
11.下列说法正确的是( )
| A. | 不含其他杂质的天然油脂属于纯净物 | |
| B. | 油脂在酸性条件下水解称为皂化 | |
| C. | 油脂的烃基部分饱和程度越大,熔点越低 | |
| D. | 各种油脂水解后的产物中都有甘油 |
18.下列说法正确的是( )
| A. | 二氧化硅是酸性氧化物,它可以跟碱反应,不能和任何酸反应 | |
| B. | 水玻璃中通入过量的二氧化碳的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 石英可以用来生产玻璃 | |
| D. | 晶体硅常被用来制造光导纤维 |
8.请选用合适的试剂及操作方法除去下列物质中的杂质,并将相应的序号填写到表格中.
所加试剂有:①NaOH溶液 ②盐酸 ③过量铁粉 ④Ba(OH)2溶液
除杂的操作方法有:A.萃取 B.加热 C.过滤 D.重结晶 E.点燃.
所加试剂有:①NaOH溶液 ②盐酸 ③过量铁粉 ④Ba(OH)2溶液
除杂的操作方法有:A.萃取 B.加热 C.过滤 D.重结晶 E.点燃.
| 编号 | 物质 | 杂质(少量) | 试 剂 | 除杂操作方法 |
| (1) | Na2CO3固体 | NaHCO3 | - | |
| (2) | Fe | Al | ||
| (3) | FeSO4 | CuSO4 | ||
| (4) | NaOH | Na2CO3 | ||
| (5) | KNO3 | NaCl | - |
13.下列关于烃性质的说法正确的是( )
| A. | 乙烯可以与酸性高锰酸钾溶液反应 因此可以用酸性高锰酸钾溶液除去乙烷中的乙稀 | |
| B. | 溴乙烷可以通过乙稀与溴化氢加成得到 也可以通过乙烷与溴发生取代反应制备 | |
| C. | 区分甲苯和苯可以用酸性高锰酸钾溶液也可以用溴水 | |
| D. | 鉴别己烯是否混有少量甲苯 正确的实验方法是可以加足量溴水 然后再加入酸性高锰酸钾溶液 |
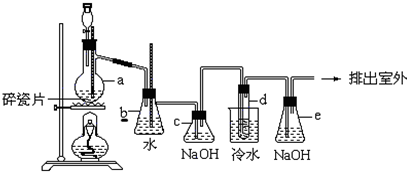
 肼是重要的化工原料,某探究小组利用下列反应制取水合肼(N2H4•H2O):
肼是重要的化工原料,某探究小组利用下列反应制取水合肼(N2H4•H2O):