题目内容
8.工业上制备溴单质时常用纯碱溶液吸收溴,发生的反应为:3Br2+6Na2CO3+3H2O═5NaBr+NaBrO3+6NaHCO3,下列有关说法正确的是( )| A. | 上述反应若有0.9molBr2反应,转移电子为1.5×6.02×1023个 | |
| B. | 反应后溶液的PH增大 | |
| C. | 若将NaBr和NaBrO3转变为Br2,需要在碱性条件下进行 | |
| D. | 该反应Na2CO3既是氧化剂又是还原剂 |
分析 A.反应中部分Br元素的化合价从0价升高到+5价,部分Br元素的化合价从0价升降低到-1价,根据化合价的变化分析;
B.反应中Na2CO3转化为NaHCO3;
C.若将NaBr和NaBrO3转变为Br2,还会生成水,由元素守恒分析;
D.反应中只有Br元素的化合价变化.
解答 解:A.反应中部分Br元素的化合价从0价升高到+5价,部分Br元素的化合价从0价升降低到-1价,3mol3Br2反应转移5mol电子,则若有0.9molBr2反应,转移电子为1.5×6.02×1023个,故A正确;
B.反应中Na2CO3转化为NaHCO3,碳酸钠的碱性大于碳酸氢钠,所以反应后溶液的PH减小,故B错误;
C.若将NaBr和NaBrO3转变为Br2,还会生成水,由元素守恒可知,反应要消耗氢离子,即在酸性条件下发生,故C错误;
D.反应中只有Br元素的化合价变化,Na2CO3既不是氧化剂又不是还原剂,故D错误.
故选A.
点评 本题考查了氧化还原反应,题目难度不大,侧重于电子转移和氧化还原反应原理的考查.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.关于自来水制蒸馏水实验的叙述不正确的是( )
| A. | 该实验的标准装置包括的玻璃仪器有:酒精灯、圆底烧瓶、直形冷凝管和锥形瓶 | |
| B. | 进行蒸馏实验,装置内部应保持与大气相通以保证安全 | |
| C. | 冷凝水应该从下口进,上口出 | |
| D. | 实验结束时应该先熄灭酒精灯,后停止通冷凝水 |
3.某污水中含CN-amg•L-1,现用ClO2将CN-氧化,只生成两种无毒气体.处理100m3这种污水,至少需要ClO2的物质的量为( )
| A. | $\frac{50a}{13}$ mol | B. | $\frac{50a}{26}$mol | C. | $\frac{25a}{13}$mol | D. | $\frac{100a}{13}$mol |
13. 如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH30H+302→2C02+4H20.下列说法正确的是( )
如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH30H+302→2C02+4H20.下列说法正确的是( )
 如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH30H+302→2C02+4H20.下列说法正确的是( )
如图是甲醇燃料电池的结构示意图.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:2CH30H+302→2C02+4H20.下列说法正确的是( )| A. | 左电极为电池的负极,a处通入的物质是甲醇 | |
| B. | 右电极为电池的负极,b处通入的物质是空气 | |
| C. | 负极反应式为:CH30H+H20-6e-→CO2+6H+ | |
| D. | 正极反应式为:02+2H20+4e-→40H- |
17.下列说法不正确的是( )
| A. | 定容时,因不慎使液面高于容量的刻度线,可用滴管将多余液体吸出 | |
| B. | 焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧,然后再进行实验 | |
| C. | 将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色 | |
| D. | 取少量晶体放入试管中,再加入适量NaOH溶液,加热,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明该晶体中含有NH4+ |
18.选用适当的催化剂是改变反应速率常用的有效方法之一.某实验小组以H2O2分解为例,探究Fe3+和Cu2+对H2O2分解的催化效果.
仪器任选.限选试剂:5% H2O2溶液、胆矾晶体、0.05mol/L Fe2(SO4)3溶液、0.1mol/L Fe2(SO4)3溶液、0.1mol/L Na2SO4溶液、蒸馏水.
Ⅰ.配制100mL 0.1 mol/LCuSO4溶液
(1)需用托盘天平称取2.5g胆矾晶体,溶解胆矾晶体时需要的玻璃仪器是烧杯和玻璃棒.
(2)如图是实验小组配制100mL 0.1mol/LCuSO4溶液过程中定容操作的示意图,该操作的错误之处未用胶头滴管定容、定容时应平视液面.
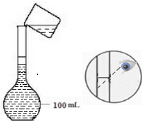
(3)若其他操作均正确,按照图示观察方法定容,所配溶液浓度偏高.(填“偏高”或“偏低”)
Ⅱ.探究Fe3+和Cu2+对H2O2分解的催化效果
实验小组用右下图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:

(4)除上述装置中的仪器及量筒外,还要用到的计量工具是秒表.为确保实验的准确性,实验前需检查该装置的气密性,操作是关闭分液漏斗活塞,向右端滴定管中加水,如果一段时间后,滴定管中液面不再下降,说明气密性良好..
(5)实验①④的主要目的是排除SO42-对双氧水分解速率的影响.
(6)实验②中选用试剂的体积v1=5mL.
(7)实验③中选用的试剂M是0.05mol/LFe2(SO4)3溶液;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+和Cu2+对H2O2分解均有催化作用,但Fe3+的催化效果更好.
仪器任选.限选试剂:5% H2O2溶液、胆矾晶体、0.05mol/L Fe2(SO4)3溶液、0.1mol/L Fe2(SO4)3溶液、0.1mol/L Na2SO4溶液、蒸馏水.
Ⅰ.配制100mL 0.1 mol/LCuSO4溶液
(1)需用托盘天平称取2.5g胆矾晶体,溶解胆矾晶体时需要的玻璃仪器是烧杯和玻璃棒.
(2)如图是实验小组配制100mL 0.1mol/LCuSO4溶液过程中定容操作的示意图,该操作的错误之处未用胶头滴管定容、定容时应平视液面.

(3)若其他操作均正确,按照图示观察方法定容,所配溶液浓度偏高.(填“偏高”或“偏低”)
Ⅱ.探究Fe3+和Cu2+对H2O2分解的催化效果
实验小组用右下图所示装置,选取相关试剂,设计并进行以下实验.忽略其他因素的影响,实验中相关数据记录如下表:
| 实验序号 | 5% H2O2溶液的体积(mL) | 选用试剂 | 选用试剂体积(mL) | 收集V mL O2所需时间(min) |
| ① | 10 | 蒸馏水 | 5 | m |
| ② | 10 | 0.1mol/L CuSO4 | v1 | n |
| ③ | 10 | 试剂M | 5 | p |
| ④ | 10 | 0.1mol/L Na2SO4 | 5 | m |

(4)除上述装置中的仪器及量筒外,还要用到的计量工具是秒表.为确保实验的准确性,实验前需检查该装置的气密性,操作是关闭分液漏斗活塞,向右端滴定管中加水,如果一段时间后,滴定管中液面不再下降,说明气密性良好..
(5)实验①④的主要目的是排除SO42-对双氧水分解速率的影响.
(6)实验②中选用试剂的体积v1=5mL.
(7)实验③中选用的试剂M是0.05mol/LFe2(SO4)3溶液;若正确选用试剂进行实验,测得收集V mL O2所需时间m>n>p,由此得出的实验结论是Fe3+和Cu2+对H2O2分解均有催化作用,但Fe3+的催化效果更好.
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.