题目内容
把在空气中久置的铝片
(1)曲线由0→a段不产生氢气的原因是_____________,有关化学方程式为_______________。
(2)曲线由a→c段,产生氢气的速率增加较快的主要原因是_____________________________。
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是______________________________。
解析:在空气中久置的铝片表面有氧化铝薄膜,因此,硫酸首先和氧化铝反应,不产生氢气;a→c段,虽然硫酸的浓度减小,但是该反应是放热反应,反应进行中温度逐渐升高,温度升高,化学反应速率加快;曲线c以后,硫酸的浓度逐渐减小,成为影响化学反应速率的主要因素,因此,化学反应速率逐渐下降。
答案:(1)硫酸首先和氧化铝反应,不产生氢气 Al2O3+3H2SO4![]() Al2(SO4)3+3H2O
Al2(SO4)3+3H2O
(2)随着反应的进行,反应中释放的热量使温度升高,反应速率加快
(3)硫酸逐渐消耗,浓度变小,该因素变为影响反应速率的主要因素,使反应速率减小

练习册系列答案
相关题目
 把在空气中久置的铝片5.0g投入盛有500mL0,5mol?L-1盐酸溶液的烧杯中该铝片与盐酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL0,5mol?L-1盐酸溶液的烧杯中该铝片与盐酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题: (2011?鹰潭二模)把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )
(2011?鹰潭二模)把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )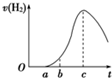 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.