题目内容
(8分)把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:

(1)曲线由O →a段不产生氢气的原因是____________________________________________________________;
有关反应的化学方程式为
__________________________________________________;
(2)曲线a→c段,产生氢气的速率增加较快的主要原因是
________________________________________________________________________
________________________________________________________________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________________________;
(4)该反应若使用催化剂,可使H2产量增多吗?______(填“会”或“不会”)。
(8分)(1)硫酸首先和氧化铝反应,不产生H2 Al2O3+3H2SO4===Al2(SO4)3+3H2O
(2)反应放热,温度升高是影响反应速率的主要因素,使反应速率增大
(3)硫酸的浓度逐渐减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降
(4)不会
【解析】(1)用于在铝片表面有一层氧化镁氧化铝,所以)硫酸首先和氧化铝反应,不产生H2 ,方程式为Al2O3+3H2SO4===Al2(SO4)3+3H2O。
(2)根据影响反应速率的外界条件可知,引起反应速率加快的原因是温度。这是原因反应是放热反应,温度升高使反应速率增大,即温度的影响超过了浓度减小对反应速率的影响。
(3)由于随着反应的进行,硫酸的浓度逐渐减小,该因素变为影响化学反应速率的主要因素,化学反应速率开始下降。
(4)催化剂只能改变反应速率,但不能改变反应物的转化率,所以氢气的量是不变的。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案 把在空气中久置的铝片5.0g投入盛有500mL0,5mol?L-1盐酸溶液的烧杯中该铝片与盐酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL0,5mol?L-1盐酸溶液的烧杯中该铝片与盐酸反应产生氢气的速率与反应时间可用如图所示的坐标曲线来表示,回答下列问题: (2011?鹰潭二模)把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )
(2011?鹰潭二模)把在空气中久置的铝片5.0g投入盛有 500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如图的坐标曲线来表示,下列推论错误的是( )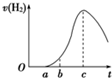 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示.