题目内容
3.常温下,0.1mol/L某一元酸(HA)溶液中c(H+)=1×10-3,下列叙述正确的是( )| A. | 溶液中水电离出的c(H+)=10-3mol/L | |
| B. | 溶液中c(A-)=10-3mol/L | |
| C. | 溶液中加水稀释,促进HA电离,溶液的c(H+)增大,但k不变 | |
| D. | 与0.1mol/LNaOH溶液等体积混合后所得溶液中(体积变化忽略不计)c(Na+)═c(A-)+c(OH-)-c(H+)=0.1 mol/L |
分析 常温下0.1mol/L某一元酸(HA)溶液中c(H+)=1×10-3,说明HA为弱酸,在溶液中存在电离平衡,
A.酸电离出的氢离子抑制了水的电离,溶液中氢氧根离子是水电离的,结合水的离子积计算水电离的氢离子浓度;
B.溶液中氢氧根离子浓度较小,根据电荷守恒计算;
C.稀释HA溶液后HA的电离程度增大,但溶液中氢离子浓度减小;
D.两溶液恰好反应生成NaA,根据电荷守恒判断.
解答 解:常温下0.1mol/L某一元酸(HA)溶液中c(H+)=1×10-3,说明HA为弱酸,在溶液中存在电离平衡,
A.酸电离出的氢离子抑制了水的电离,溶液中氢氧根离子是水电离的,则水电离的氢离子浓度为:c(H+)=10-11mol/L,故A错误;
B.根据电荷守恒可知c(A-)=c(H+)-c(OH-)≈10-3mol/L,故B正确;
C.稀释HA溶液后,HA的电离程度增大,电离平衡常数K不变,但溶液中氢离子浓度减小,故C错误;
D.与0.1mol/LNaOH溶液等体积混合后恰好反应生成NaA,根据电荷守恒可知所得溶液中(体积变化忽略不计)c(Na+)═c(A-)+c(OH-)-c(H+)=0.05 mol/L,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确弱电解质电离平衡及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
13.下列4个有机化合物中,能够发生酯化、加成和氧化3种反应的是( )
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH2OH ④CH2=CHCH2OH⑤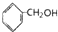
①CH2=CHCOOH ②CH2=CHCOOCH3 ③CH3CH2CH2OH ④CH2=CHCH2OH⑤

| A. | ①③ | B. | ①④⑤ | C. | ②④ | D. | ①②③⑤ |
14.在2L密闭容器中,某气体反应物在2s内由8mol变为7.2mol,则用此反应物表示该反应的平均反应速率为( )
| A. | 0.4 mol•(L•s)-1 | B. | 0.3 mol•(L•s)-1 | C. | 0.2 mol•(L•s)-1 | D. | 0.1 mol•(L•s)-1 |
18.A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-.B2+和C-具有相同的电子层结构.下列说法中,正确的是( )
| A. | 原子序数B>A>C | B. | 原子半径A>B>C | ||
| C. | 离子半径A2->B2+>C- | D. | 原子最外层电子数C>A>B |
15.下列有关胶体的说法正确的是( )
| A. | 胶体比溶液更稳定 | |
| B. | 从外观一定能区别溶液和胶体 | |
| C. | 用渗析的方法净化胶体时,使用的半透膜只能让离子、小分子通过 | |
| D. | 淀粉溶液不是胶体 |


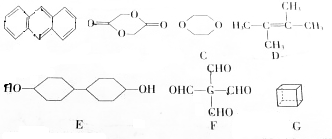
 ,下列相关离子方程式或化学方程式错误的是
,下列相关离子方程式或化学方程式错误的是