题目内容
【题目】现有常温下的四种溶液(如下表),下列有关叙述中正确的是( )
① | ② | ③ | ④ | |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 硫酸 |
pH | 11 | 11 | 3 | 3 |
A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11
C.分别加水稀释10倍、四种溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合,所得溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
【答案】D
【解析】
A.在①中加入适量的氯化铵晶体后,氨根离子可抑制氨水的电离,碱性减弱,②中分别加入适量的氯化铵晶体后,强碱制弱碱,碱性减弱,pH均减小,故A错误;
B.两溶液混合后呈酸性,故酸过得,则:![]() ,故B错误;
,故B错误;
C.稀释后酸的酸性减弱、碱的碱性减弱,但弱电解质在稀释过程中可促进其电离,故其酸碱性减弱的程度均略小,所以分别加水稀释10倍后四种溶液的pH:①>②>④>③,故C错误;
D.pH之和为14的酸碱等体积混合,则谁弱呈谁性,所以最终溶液呈碱性,即c(OH-)>c(H+);又溶液主要是(NH4)2SO4,主要离子当然是c(NH4+)>c(SO42-),故D正确;
故答案为D。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:
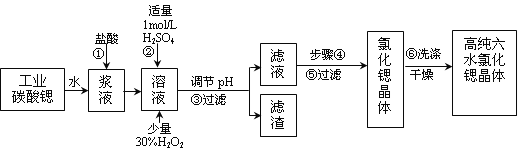
已知:Ⅰ.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
Ⅱ.SrCl2·6H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
(1)操作①需要加快反应速率,措施有充分搅拌和____________________(写一种)。碳酸锶与盐酸反应的离子方程式________________________________。
(2)在步骤②~③的过程中,将溶液的pH值由1调节至_______;宜用的试剂为_______。
A.1.5 B.3.7 C.9.7 D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是_______________________(填化学式)。
(4)工业上用热风吹干六水氯化锶,适宜的温度是_______。
A.50~60℃ B.80~100℃ C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是_______________。





