题目内容
4.将足量CO2气体通入水玻璃(Na2SiO3溶液)中,然后加热蒸干,再在高温下充分灼烧,最后所得的固体物质是( )| A. | Na2CO3、Na2SiO3 | B. | Na2CO3、SiO2 | C. | Na2SiO3 | D. | SiO2 |
分析 向硅酸钠溶液中通入足量二氧化碳,二氧化碳和硅酸钠反应生成硅酸和碳酸氢钠;蒸干时碳酸氢钠分解生成碳酸钠,硅酸分解生成二氧化硅;高温条件下灼烧混合物,二氧化硅和碳酸钠反应,据此确定最终产物的成分.
解答 解:二氧化碳先与水玻璃反应生成硅酸和碳酸氢钠,蒸干灼烧时,硅酸分解成二氧化硅和水,碳酸氢钠分解得到碳酸钠、二氧化碳和水;二氧化硅和碳酸钠在高温下又发生反应,生成二氧化碳和硅酸钠,所以最终所得固体是硅酸钠.
故选C.
点评 本题考查了硅的化合物的性质,明确“常温下二氧化碳能和硅酸钠溶液反应生成硅酸;高温条件下,二氧化硅和碳酸钠能反应生成二氧化碳和硅酸钠”是解本题的关键,难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
14.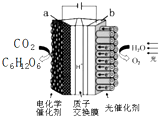 中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )
中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )
 中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )
中关村“创客19”实验室模拟光合作用的电化学实验装置如右图所示,该装置能将H2O和CO2转化为O2和葡萄糖(C6H12O6).下列说法正确的是( )| A. | 该装置是新型化学电源装置 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a 电极的反应为:6CO2+24H+-24e-=C6H12O6+6 H2 O |
15.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA | |
| B. | 足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA | |
| C. | 密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA | |
| D. | 3 g乙烷含有共用电子对为0.6 NA |
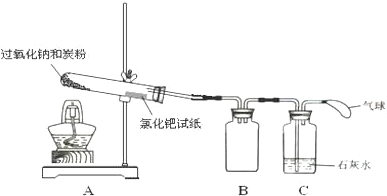
12.如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )


| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 若A为醋酸,B为碳酸钙,C中盛澄清石灰水,则C中溶液变浑浊 | |
| C. | 若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀,后沉淀又溶解 | |
| D. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
9.下列物质的制备操作,可以达到实验目的是( )
| A. | 向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体 | |
| B. | 用铁和Cl2加热制取FeCl3 | |
| C. | 用铜粉和硫粉混合加热制备CuS | |
| D. | 向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3 |
16.向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化,如图所示,各条曲线与溶液中离子数目的大致对应关系描述正确的是( )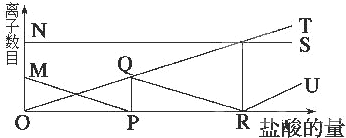

| A. | NS:K+; MP:H+; QR:CO32-; OT:HCO3-; RU:Cl- | |
| B. | NS:K+; MP:CO32-; OQR:HCO3-; OT:Cl-; RU:H+ | |
| C. | NS:K+; MP:Cl-; QR:H+; OT:HCO3-; RU:CO32- | |
| D. | NS:K+; MP:H+; OQR:Cl-; OT:C32-; RU:HCO3- |
13.下列表示正确的是( )
| A. | CO2的电子式: | B. | 乙烯的结构式:CH2═CH2 | ||
| C. | CH4的比例模型: | D. | Cl-离子的结构示意图: |
14.工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3•9H2O]的流程如下:

下列说法错误的是( )

下列说法错误的是( )
| A. | 试剂X选用稀硝酸最合适 | |
| B. | 滤渣Y的主要成分为Fe2O3 | |
| C. | 反应I 中发生的反应之一为Al2O3+2OH-=2AlO2-+H2O | |
| D. | 减压蒸发结晶不能改为常压蒸发结晶 |