题目内容
12.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有16O的物质有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 乙酸与乙醇的酯化反应中:乙酸中的羧基提供羟基、乙醇中的羟基提供氢原子,羟基和氢原子形成水,剩下基团结合的形成酯,以此解答该题.
解答 解:若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生酯化反应的化学方程式为:CH3C18O18OH+H16OCH2CH3$?_{△}^{浓硫酸}$CH3C18O16OCH2CH3+H218O,
根据反应可知,酯化反应是可逆反应,所以含有16O的物质有:CH3CH216OH、CH3C18O16OCH2CH32种物质,
故选B.
点评 本题考查了酯化反应原理,为高频考点,题目难度不大,明确酯化反应原理“酸脱羟基醇脱氢”含义为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
20.海水资源的综合利用十分重要,不需要通过化学变化就能够从海水中获得的物质是( )
| A. | 食盐 | B. | 钠 | C. | 溴 | D. | 碘 |
7.下列物质的名称或化学式与颜色不一致的是( )
| A. | S(淡黄色) | B. | NO(无色) | C. | 无水硫酸铜(蓝色) | D. | NO2(红棕色) |
4.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.8g铁粉与50mL4mol•L-1盐酸反应转移电子的数目为0.15NA | |
| B. | 常温下1LpH=13的氢氧化钠溶液中由水电离出的H+的数目为0.1NA | |
| C. | 标准状况下,8.96L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.2NA | |
| D. | 1.2g金刚石与石墨的混合物中含有碳碳单键的数目为0.4NA |
1.下列性质的递变规律正确的是( )
| A. | HF、H2O、PH3的稳定性依次增强 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐减弱 | |
| C. | Al3+、Mg2+、Na+的离子半径依次减小 | |
| D. | NaOH、KOH、CsOH碱性依次增强 |
16.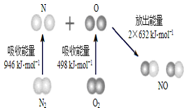 根据如图所示的N2 (g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是( )
根据如图所示的N2 (g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是( )
 根据如图所示的N2 (g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是( )
根据如图所示的N2 (g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是( )| A. | N2(g) 与O2(g)反应生成NO(g)是放热反应 | |
| B. | 2 mol O原子结合生成O2(g)时需要吸收498 kJ能量 | |
| C. | 1 mol NO(g)分子中的化学键断裂时需要吸收632 kJ能量 | |
| D. | 该反应中反应物总能量高于生成物总能量 |

 为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如图所示的实验装置.实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶Ⅰ中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空.
为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如图所示的实验装置.实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶Ⅰ中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空.