题目内容
【题目】过氧乙酸(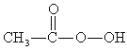 )是一种高效消毒剂,常用于环境消毒杀菌,可以迅速杀死多种微生物。它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
)是一种高效消毒剂,常用于环境消毒杀菌,可以迅速杀死多种微生物。它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
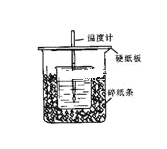
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水。
②不断搅拌并控制B中混合液的温度为20~30℃至反应结束。
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品。
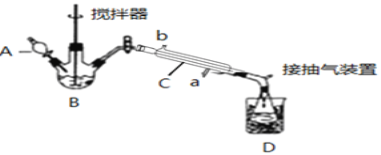
请回答下列问题:
(1)仪器B的名称是__;仪器C中冷水流入口是__(填a或b);
(2)为更好地控制反应温度,应采用方法是__;
(3)生成过氧乙酸的化学方程式为__;
(4)不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见下表),由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是__,反应所需时间约__(选填1、3、5、7)小时;
反应物比例CH3COOH/H2O2 | 反应时间(小时) | ||||
0.5 | 1 | 3 | 5 | 7 | |
2∶1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
1∶1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
1∶2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(5)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率;可供选择的试剂和主要器材有:a.过氧乙酸溶液、b.1mol/L的FeCl3溶液、c.0.5mol/L的Fe2(SO4)3溶液、d.0.5mol/L的CuCl2溶液、e.1mol/L的CuSO4溶液、f.计时器、g.测量气体体积的针筒、i.带导气管的试管。
你选择的试剂及器材是a、__、f
(6)碘量法取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KMnO4溶液至恰好粉红色以除去残余H2O2,再加入10mL10%KI溶液和几滴淀粉溶液,摇匀,反应完全后再用0.1000mol/L的Na2S2O3标准液滴定至终点(反应方程式为2Na2S2O3+I2=Na2S4O6+2NaI),共消耗14.30mLNa2S2O3标准液。该样品中过氧乙酸的物质的量浓度是__mol/L。(结果保留小数点后两位)
提示:CH3COOOH+2I-+2H+=I2+CH3COOH+H2O)
【答案】三颈瓶(或三颈烧瓶) a 对B仪器进行水浴加热 CH3COOH+H2O2![]() CH3COOOH+H2O 1∶1 5 ce 将导气管与针筒连接,取等量的过氧乙酸溶液(或a)分别加入两支试管中,再分别加入等体积的0.5mol/L的Fe2(SO4)3溶液(或c)和1mol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间) 7.15
CH3COOOH+H2O 1∶1 5 ce 将导气管与针筒连接,取等量的过氧乙酸溶液(或a)分别加入两支试管中,再分别加入等体积的0.5mol/L的Fe2(SO4)3溶液(或c)和1mol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间) 7.15
【解析】
根据仪器结构判断仪器名称,结合反应条件分析加热方式;结合题中信息,写出生成过氧乙酸的化学反应方程式;CH3COOOH+2I+2H+ =I2+CH3COOH +H2O,2Na2S2O3+I2=Na2S4O6+2NaI,由这两个方程式,确定关系式:CH3COOOH~I2~2Na2S2O3,计算稀释后5.00mL溶液中过氧乙酸的物质的量,再计算原来的2.00mL溶液中的过氧乙酸的物质的量,再根据物质的量浓度定义式计算。
(1)根据实验仪器结构分析可知,仪器B为三颈烧瓶,仪器C为冷凝管,作用是冷凝蒸汽,采用逆流冷凝,冷水从a口流入,故答案为:三颈瓶(或三颈烧瓶);a;
(2)该反应需要控制B中混合液的温度为20~30℃至反应结束,为更好地控制反应温度,应采用方法是水浴加热,故答案为:对B仪器进行水浴加热;
(3)冰醋酸与过氧化氢在浓硫酸催化生成过氧乙酸,反应为CH3COOH+H2O2![]() CH3COOOH+H2O,故答案为:CH3COOH+H2O2
CH3COOOH+H2O,故答案为:CH3COOH+H2O2![]() CH3COOOH+H2O;
CH3COOOH+H2O;
(4)由表中数据可知(![]() )为1:1时,相同的反应时间下生成过氧乙酸含量(%)较高;此时随着反应时间的增加,产量增大,超过5小时,时间增加,产量增加的不多,故选择5小时最佳,故答案为:1:1;5;
)为1:1时,相同的反应时间下生成过氧乙酸含量(%)较高;此时随着反应时间的增加,产量增大,超过5小时,时间增加,产量增加的不多,故选择5小时最佳,故答案为:1:1;5;
(5)比较Fe3+、Cu2+对过氧乙酸的催化效率,选择相同浓度的Fe3+、Cu2+对相同过氧乙酸反应的生成气体的时间快慢作比较。为减小误差,选择等浓度的Fe3+、Cu2+盐溶液,且阴离子相同,故选择Fe2(SO4)3溶液和1mol/L的CuSO4溶液,方法为:试管连接针筒,检查装置气密性,取等量的过氧乙酸溶液(或a)加入试管中,再分别加入等量的0.5 mol/L的Fe2(SO4)3溶液(或c)和1mol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间),故答案为:ce;将导气管与针筒连接,取等量的过氧乙酸溶液(或a)分别加入两支试管中,再分别加入等体积的0.5 mol/L的Fe2(SO4)3溶液(或c)和1mol/L的CuSO4溶液(或e),记录相同时间产生气体体积(或产生等体积气体的时间);
(6)过氧乙酸氧化碘离子:CH3COOOH+2H++2I-=I2+CH3COOH+H2O,又2Na2S2O3+I2═Na2S4O6+2NaI,可以得关系式如下:CH3COOOH~I2~2Na2S2O3,由关系式可知,n(CH3COOOH)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×0.1000mol/L×0.01430L=7.15×10-4mol,故原样品中w(CH3COOOH)=
×0.1000mol/L×0.01430L=7.15×10-4mol,故原样品中w(CH3COOOH)= =7.15mol/L;故答案为7.15。
=7.15mol/L;故答案为7.15。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
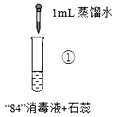
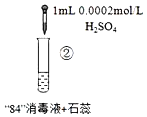
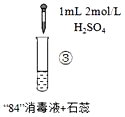
激活思维优加课堂系列答案【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用