题目内容
将a g Fe,Mg合金溶解在一定量的稀硝酸中,当合金完全溶解后,收集到标准状况下的NO气体b L(设HNO3的还原产物只有NO).再向反应后的溶液中加入足量的NaOH溶液,得到沉淀.试计算该沉淀的质量(以a,b字母表示).
答案:
解析:
解析:
|
解:由于反应中Fe有可能生成+2,+3价的化合物,故设其反应生成物中铁元素的平均价为+n,由题意可知: Fe,Mg→Fe(NO3)n,Mg(NO3)2→Fe(OH)n, Mg(OH)2,反应后得到的沉淀的质量应为原来金属的质量与生成物中OH-的质量之和. 设原合金中Fe,Mg的物质的量分别为x,y,则 m(沉淀)=a+17(n x+2y).又根据合金与硝酸反应时电子得失守恒,可得出关系式:n x+2y=3× 所以m(沉淀)=a+ |

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
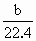 .
.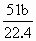 .
.