题目内容
18.含有10个电子八种微粒(离子或分子)分别用A+、B-、C2-、D、E和F表示,请回答:(1)A元素是钠、B元素是氟、C元素是氧 (用元素名称表示)
(2)D是由两种元素组成的双原子分子,其分子式是HF
(3)E是有两种元素组成的三原子分子,其分子式是H2O,电子式
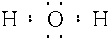
(4)F分子中含有4个原子,其分子式是NH3
(5)若A+、B-为原子团,在溶液中加热能反应,则离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
分析 含有10个电子的微粒有:CH4、NH3、H2O、HF、NH4+、OH-、H3O+、O2-、F-、Na+、Mg2+、Al3+等,根据各离子的组成和性质解答该题.
解答 解:(1)A+表示含有10个电子的微粒,A+表示核外失去一个电子,那么该微粒的质子数为11,则该元素为钠(Na),
B-表示含有10个电子的微粒,B-表示核外得到1个电子,那么该微粒的质子数为9,则该元素为氟(F),
C2-表示含有10个电子的微粒,C2-表示核外得到2个电子,那么该微粒的质子数为8,则该元素为氧(O),
故答案为:钠、氟、氧;
(2)D 是由两种元素组成的双原子分子,且含有10个电子,则该物质是HF,故答案为:HF;
(3)E是由两种元素组成的含有三个原子的分子,含有10个电子的微粒,可推知其分子式是H20,电子式为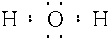 ,
,
故答案为:H2O;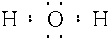 ;
;
(4)F是由两种元素组成的含有4个原子的分子,含有10个电子的微粒,可推知其分子式是NH3,
故答案为:NH3;
(5)若A+、B-为原子团,在溶液中加热能反应,应为NH4+和OH-的反应,生成H2O和NH3,反应的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
点评 本题考查常见10电子粒子的结构和性质,侧重于学生的分析能力的考查,题目难度中等,注意常见10电子粒子和18电子粒子的归纳来解答.

练习册系列答案
相关题目
3. 用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
 用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )| A. | 阴极的电极反应式为:Cl-+2OH--2e -=ClO-+H2 O | |
| B. | 阳极的电极反应式为:2CN-+12OH--10e-=N2↑+2CO 32-+6H2O | |
| C. | 电解时使用锂钒氧化物二次电池(V2O5+xLi$?_{充电}^{放电}$LixV2O5)做电源,电池充电时a 电极的电极反应式为:LixV2O5_xe-=V2O5+xLi+ | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O |
6.有关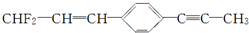 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )
 的下列叙述中,正确的是( )
的下列叙述中,正确的是( )| A. | 该有机物物质的类别为:卤代烃、烯烃、炔烃 | |
| B. | 该有机物分子式:C12H9F2 | |
| C. | 最多有8个碳原子在同一直线上 | |
| D. | 12个碳原子有可能都在同一平面上 |
13.据报道,近来发现了一种新的星际分子氰基辛炔,其结构简式为HC≡C-C≡C-C≡C-C≡N对该物质的判断不正确的是( )
| A. | 其分子中的原子都在一条直线上 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生加成反应 | D. | 可由乙炔和含氮化合物加聚制得 |
7.下列各组物质各自形成的晶体,均属于分子晶体的化合物是( )
| A. | NH3,K2O,C4H10 | B. | CH4,CO2,H2SO4 | C. | SO2,SiO2,P2O5 | D. | CCl4,Na2S,H2O2 |
8.下列有机物分离提纯的方法正确的是( )
| A. | 除去苯中少量苯酚,加入适量浓溴水,过滤 | |
| B. | 除去乙烷中的乙烯,把混合气体通入酸性高锰酸钾溶液中 | |
| C. | 除去丁醇中的乙醚,用蒸馏法 | |
| D. | 提纯蛋白质时可先加入(CH3COO)2Pb溶液,过滤后再加水重新溶解 |




