题目内容
一定温度下,4个容器均为1L的容器中,分别进行反应:C(s)+H2O(g) 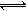 CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是
CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是 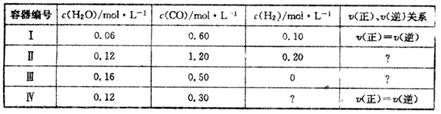
A.在容器Ⅱ中,v(正)<v(逆)
B.在容器Ⅳ中,H2的浓度为0.40 mol.L-1
C. 在容器Ⅲ中, 反应达到平衡时吸收的热量为13.13 KJ
D.若将平衡时容器Ⅰ、Ⅳ中的物质混合于容积为1L的容器中,则反应仍处于平衡状态
【答案】
D
【解析】根据I可知,该反应的平衡常数为 ,在实验Ⅱ中
,在实验Ⅱ中 >1,所以反应向逆反应方向移动,A正确。根据平衡常数可知
>1,所以反应向逆反应方向移动,A正确。根据平衡常数可知 ,解得x=0.4mol/L,B正确。选项C中设平衡时生成氢气x,则
,解得x=0.4mol/L,B正确。选项C中设平衡时生成氢气x,则 ,解得x=0.1mol/L,所以吸收的热量是13.13
KJ,C正确。由于平衡时容器Ⅰ、Ⅳ中的平衡状态不同,所以混合后,平衡发生移动,D不正确,答案选D。
,解得x=0.1mol/L,所以吸收的热量是13.13
KJ,C正确。由于平衡时容器Ⅰ、Ⅳ中的平衡状态不同,所以混合后,平衡发生移动,D不正确,答案选D。

练习册系列答案
相关题目
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ?mol-1
(1)该反应的平衡常数K随温度的升高而______(增大/减小/不变).
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡______(向左移/向右移/不移动).
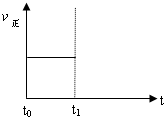
(3)上述反应在t时刻达到平衡(如图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①缩小容器体积(用实线表示)
②降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
(5)己知:2C (s)+O2(g)=2CO (g)△H=-221.0kJ?mo1-1
2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ?mo1-1
2H2 (g)+O2 (g)=2H2O (g)△H=-483.6kJ?mo1-1
若将24g 炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为______kJ.

C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ?mol-1
(1)该反应的平衡常数K随温度的升高而______(增大/减小/不变).
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡______(向左移/向右移/不移动).
(3)上述反应在t时刻达到平衡(如图),若在t1时刻改变某一条件,请在下图中继续画出t1时刻之后正反应速率(ν正)随时间的变化:
①缩小容器体积(用实线表示)
②降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ______ | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正______ν逆 |
2CO(g)+O2(g)=2CO2 (g)△H=-566.0kJ?mo1-1
2H2 (g)+O2 (g)=2H2O (g)△H=-483.6kJ?mo1-1
若将24g 炭完全转化为水煤气,然后再充分燃烧,整个过程的焓变为______kJ.

一定温度下,4个容器均为1L的容器中,分别进行反应:C(s)+H2O(g)  CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是
CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是 
| A.在容器Ⅱ中,v(正)<v(逆) |
| B.在容器Ⅳ中,H2的浓度为0.40 mol.L-1 |
| C.在容器Ⅲ中, 反应达到平衡时吸收的热量为13.13 KJ |
| D.若将平衡时容器Ⅰ、Ⅳ中的物质混合于容积为1L的容器中,则反应仍处于平衡状态 |
 水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得: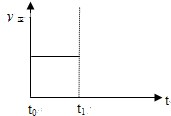 (2009?广州模拟)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
(2009?广州模拟)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得: