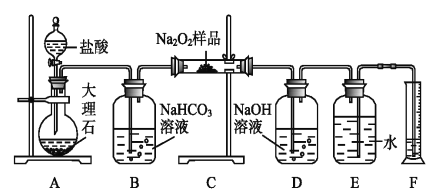
题目内容
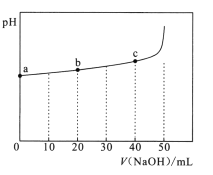
【题目】25℃时,向50mL浓度均为l.0mol/L的醋酸和醋酸钠混合溶液中,缓慢滴加1.0mol/L的NaOH溶液,所得溶液的pH变化情况如图所示(已知:25℃时,Ka(CH3COOH)=1.8×10-5)。下列叙述错误的是
A.a点溶液中,c(H+)约为![]()
B.b点溶液中,![]()
C.V(NaOH)≤50mL时,随V(NaOH)增大,溶液中离子总浓度增大
D.从a到c的过程中,溶液中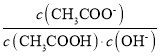 不变
不变
【答案】C
【解析】
根据Ka(CH3COOH)=1.8×10-5可知当溶液呈中性时![]() ,
,![]() ,
,
A. a点溶液中c(CH3COOH)≈c(CH3COO-),氢离子浓度主要来源于醋酸的电离:CH3COOH![]() CH3COO-+H+,
CH3COO-+H+, ![]() ,即c(H+)约为
,即c(H+)约为![]() ,故A正确;
,故A正确;
B. b点溶液中,醋酸未反应完,此时溶质为醋酸与醋酸钠,浓度之比为3:7,溶液呈酸性,醋酸钠完全电离,醋酸部分电离,则![]() ,故B正确;
,故B正确;
C. 当V(NaOH)=50mL时,溶液中溶质为醋酸钠,浓度为1.0mol/L,此时溶液中离子总浓度小于原溶液,故C错误;
D. 从a到c的过程中,温度保持不变,水解平衡常数不变,则溶液中 不变,故D正确;
不变,故D正确;
故选C。

练习册系列答案
相关题目