题目内容
12.阿伏加德罗常数的值为NA,下列叙述中正确的是( )| A. | 2 mol NaOH的摩尔质量为80g/mol | |
| B. | S2和S8的混合物共6.4 g,其中所含硫原子数一定为0.2 NA | |
| C. | 1molNa2O2与足量CO2反应转移的电子数为2NA个 | |
| D. | 0.1molKHSO4晶体中阳离子总数为0.2NA |
分析 A.摩尔质量与物质的量大小无关;
B.S2和S8均由硫原子构成,根据质量守恒计算;
C.1mol过氧化钠与足量二氧化碳反应生成0.5mol氧气,结合过氧化钠中氧元素的化合价为-1计算;
D.硫酸氢钠晶体中含有阳离子只有钾离子.
解答 解:A.NaOH的摩尔质量为40g/mol,与物质的量大小无关,故A错误;
B.S2和S8均由硫原子构成,则6.4g混合物中含有的硫原子的物质的量=$\frac{6.4g}{32g/mol}$=0.2mol,所含硫原子个数为0.2NA个,故B正确;
C.1molNa2O2与足量CO2反应生成0.5mol氧气,根据电子守恒可知转移1mol电子,转移的电子数为NA,故C错误;
D.0.1molKHSO4晶体中含有0.1mol钾离子,含有阳离子总数为0.1NA,故A错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
8. 脱落酸具有催熟作用,可延长鲜花盛开时间,脱落酸的结构简式如图所示,下列说法不正确的是( )
脱落酸具有催熟作用,可延长鲜花盛开时间,脱落酸的结构简式如图所示,下列说法不正确的是( )
 脱落酸具有催熟作用,可延长鲜花盛开时间,脱落酸的结构简式如图所示,下列说法不正确的是( )
脱落酸具有催熟作用,可延长鲜花盛开时间,脱落酸的结构简式如图所示,下列说法不正确的是( )| A. | 脱落酸在一定条件下能和乙酸发生酯化反应 | |
| B. | 脱落酸分子中含有4个甲基 | |
| C. | 等量脱落酸与足量的NaHCO3、Na反应,放出CO2与H2的物质的量之比为n(CO2):n(H2)=2:1 | |
| D. | 脱落酸能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色 |
3.设NA为阿伏伽德罗常数值.下列有关叙述不正确的是( )
| A. | 1molCnH2n-2(n≥2)中所含的共用电子对数为(3n+l)NA | |
| B. | 在K37ClO3+6H35Cl(浓)═KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子 转移的数目为5NA | |
| C. | 60 克的乙酸和葡萄糖混合物充分燃烧消耗2NA个O2 | |
| D. | 5.8 g熟石膏(2CaSO4•H2O)含有的结晶水分子数为0.02NA |
20.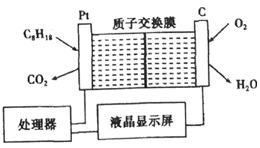 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
 为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )
为了强化安全管理,某油库引进了一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法中不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | 铂电极的电极反应式为:C8H18+16H2O-50e-═8CO2+50H+ | |
| C. | 每消耗标准状况下5.6 L O2溶液中通过lmol 电子 | |
| D. | H+由质子交换膜左侧向右侧迁移 |
7.下列说法正确的是( )
| A. | Na2O,Fe2O3、A12O3属于碱性氧化物,CO2、SO2、NO2都能和碱溶液发生反应属于酸性氧化物 | |
| B. | CaCl2、NaOH、HCl、HD四种物质都属于化合物 | |
| C. | 蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质 | |
| D. | 醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物 |
17.中学化学常见物质A、B、C、D、X、Y,存在如图转化关系(部分物质和条件略去)请根据要求回答下列问题:

(1)若A为NaOH溶液,X为CO2,D是沉淀,①则Y可为BD(填序号).
A.SO3 B.Ba(OH)2 C.H2SO4 D.CaO
②A可与C反应生成B的离子方程式为HCO3-+OH-=CO32-+H2O.
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,A与D反应生成一种化肥,
①实验室制备气体A的反应、收集和尾气处理装置如图依次为ACG.用此装置制备A的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.

②写出木炭与D的浓溶液在加热的条件下发生反应的化学方程式4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+4NO2↑.
(3)若A和X均为单质,反应Ⅲ的现象是白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,
①检验B溶液中是否存在C的试剂可选用C(填序号).
A.Cl2 B.NaOH溶液 C.酸性KMnO4 D.KSCN溶液
②C溶液在贮存时应加入少量X,其理由是(用离子方程式说明)2Fe3++Fe=3Fe2+.
(4)若A金属,D为强碱,则:
①写出A与水反应生成D的离子方程式2Na+2H2O=2Na++2OH-+2H2↑.
②反应Ⅲ中,还原剂是Na2O2.
(5)若A为淡黄色固体单质,D是强酸,
①把一定量的锌与100mL 18.5mol•L-1的D充分反应后,锌完全溶解,同时生成气体M 33.6L(标准状况).将反应后的溶液稀释到1L后溶液的c(H+)=0.1mol•L-1,则下列叙述不正确的是B.
②为了分离气体M,并分别得到干燥的气体,某学生设计了如图实验装置,a、b为活塞,且每个装置中的溶液均过量.甲容器中盛C;乙容器中盛A(填字母).
A.浓硫酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钡溶液

气体M实验时,关闭b,打开a,此时分离出的气体是H2;当分离完一种气体后,关闭a,打开b,此时得到的气体是SO2.

(1)若A为NaOH溶液,X为CO2,D是沉淀,①则Y可为BD(填序号).
A.SO3 B.Ba(OH)2 C.H2SO4 D.CaO
②A可与C反应生成B的离子方程式为HCO3-+OH-=CO32-+H2O.
(2)若A为能使湿润的红色石蕊试纸变蓝的气体,A与D反应生成一种化肥,
①实验室制备气体A的反应、收集和尾气处理装置如图依次为ACG.用此装置制备A的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.

②写出木炭与D的浓溶液在加热的条件下发生反应的化学方程式4HNO3(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2H2O+4NO2↑.
(3)若A和X均为单质,反应Ⅲ的现象是白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,
①检验B溶液中是否存在C的试剂可选用C(填序号).
A.Cl2 B.NaOH溶液 C.酸性KMnO4 D.KSCN溶液
②C溶液在贮存时应加入少量X,其理由是(用离子方程式说明)2Fe3++Fe=3Fe2+.
(4)若A金属,D为强碱,则:
①写出A与水反应生成D的离子方程式2Na+2H2O=2Na++2OH-+2H2↑.
②反应Ⅲ中,还原剂是Na2O2.
(5)若A为淡黄色固体单质,D是强酸,
①把一定量的锌与100mL 18.5mol•L-1的D充分反应后,锌完全溶解,同时生成气体M 33.6L(标准状况).将反应后的溶液稀释到1L后溶液的c(H+)=0.1mol•L-1,则下列叙述不正确的是B.
| A.气体M是SO2和H2的混合物 | B.气体M是SO2和H2的体积比为4:1 |
| C.反应中共消耗锌97.5g | D.反应中共转移电子3mol |
A.浓硫酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钡溶液

气体M实验时,关闭b,打开a,此时分离出的气体是H2;当分离完一种气体后,关闭a,打开b,此时得到的气体是SO2.
7.用NaOH溶液吸收尾气中的SO2,将所得的Na2SO3溶液进行电解再生循环脱硫,其原理如图,a、b离子交换膜将电解槽分成为三个区域,电极材料均为石墨.甲~戊分别代表生产中的原料或产品,其中丙为硫酸溶液.下列说法错误的是( )

| A. | 图中a表示阳离子交换膜 | |
| B. | 当电路中通过1mol电子的电量时,会有0.25mol的O2生成 | |
| C. | 甲为NaOH溶液 | |
| D. | 阳极的电极反应式为SO32-+H2O-2e-=SO42-+2H+ |
5.已知2H2(g)+CO(g)?CH3OH(g)为放热反应,对该反应的下列说法正确的是( )
| A. | 因该反应为放热反应,故不加热就可发生 | |
| B. | 相同条件下,2 mol H2的能量或1 mol CO的能量一定高于1 mol CH3OH的能量 | |
| C. | 相同条件下,反应物H2和 CO的总能量一定高于生成物CH3OH的总能量 | |
| D. | 达到平衡时,CO的浓度与CH3OH的浓度一定相等 |