题目内容
关于下列离子方程式的判断正确的是( )xR2++yH++O2══mR3++nH2O
A.m=4 B.m=y C.m=2 D
解析:根据O原子守恒得:n=2 ①
根据H原子守恒得:y=2n=2×2=4 ②
根据R原子守恒得:x=m ③
根据电荷守恒得:
③④联立解得:m=x=
答案:AB

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
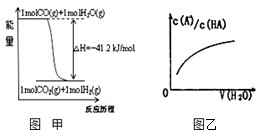 关于下列各图的叙述错误的是( )
关于下列各图的叙述错误的是( )| 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 |
| Cl2+H2?2HCl | 2.6×1033 |
| Br2+H2?2HBr | 1.9×1019 |
| I2+H2?2HI | 8.7×102 |
| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、常温下0.4 mol?L-1 HB溶液和0.2 mol?L-1NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(Na+)>c(H+)>c(OH-) | ||
| C、常温下,X2(g)和H2反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且HX的还原性逐渐减弱 | ||
D、图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|