题目内容
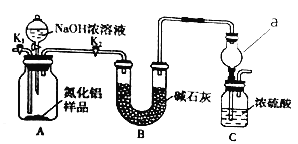
【题目】某化学研究性学习小组模拟工业上从浓缩的海水中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:![]() 的沸点为59℃,微溶于水,有毒。
的沸点为59℃,微溶于水,有毒。
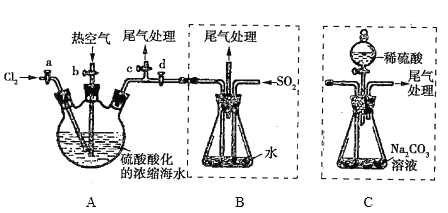
①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入![]() 至反应完全;
至反应完全;
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量![]() ;
;
④关闭活塞b,打开活塞a,再通过A向B中缓慢通人足量![]() ;
;
⑤将B中所得液体进行萃取、分液、蒸馏并收集液溴。
请回答下列问题:
(1)实验室中制备氯气的化学方程式为________________________________________________。
(2)步骤②中鼓入热空气的作用是_______________________________________。
(3)步骤③中发生的主要反应的离子方程式为_______________________________________。
(4)进行步骤③时,B中尾气可用_____(填序号)吸收处理。
a.水 b.浓硫酸 c. ![]() 溶液 d.饱和
溶液 d.饱和![]() 溶液
溶液
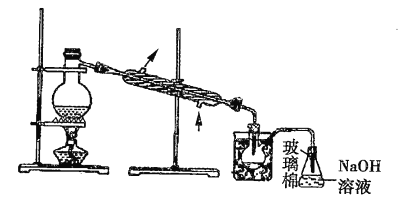
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的主要仪器补画出来___________。
(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了![]() 等物质,该反应的化学方程式为_______________。
等物质,该反应的化学方程式为_______________。
(7)与B装置相比,采用C装置的优点为______________________________________。
【答案】![]() 使A中生成的
使A中生成的![]() 随热空气流入B中
随热空气流入B中 ![]() c 缺少的主要仪器为①②③,如下图
c 缺少的主要仪器为①②③,如下图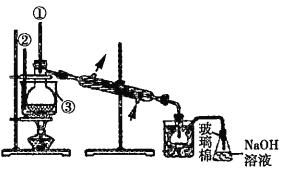
![]() 操作简单、污染小
操作简单、污染小
【解析】
实验通过反应Cl2+2Br-=2Cl-+Br2从浓缩的海水中提取溴;再利用溴单质易挥发、溴单质与二氧化硫的反应,对溴单质进行收集。
(1)实验室中制备氯气常用二氧化锰和浓盐酸反应:![]() 。
。
(2)鼓入热空气是为了将A中生成的![]() 吹入B中。
吹入B中。
(3)步骤③中发生的主要反应是Br2被二氧化硫还原为![]() 的反应,离子方程式是
的反应,离子方程式是![]() 。
。
(4)B中尾气含有![]() 、
、![]() 等,可用氢氧化钠溶液吸收。
等,可用氢氧化钠溶液吸收。
(5)蒸馏时需要温度计测定温度,为了使液体受热均匀,需采取水浴加热。
(6)![]() 与碳酸钠溶液反应生成
与碳酸钠溶液反应生成![]() ,根据氧化还原反应规律可知,该反应还生成了
,根据氧化还原反应规律可知,该反应还生成了![]() ,即
,即![]() 。
。
(7)对比B、C装置可知,采用C装置的优点为操作简单,污染小(减少二氧化硫的排放)。