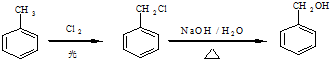
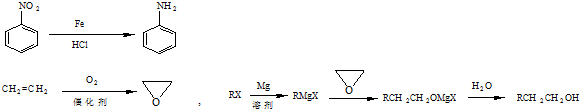题目内容
在常溫下,将pH=11的某碱溶液和pH=3的某酸溶液等体积混合后,下列说法不正确的是( )
| A、若所得溶液呈中性,则生成的盐可能为强酸强碱盐 |
| B、若所得溶液呈碱性,则可能是强碱与弱酸溶液反应 |
| C、若所得溶液呈酸性,则可能是弱酸与强碱溶液反应 |
| D、若所得溶液的pH=5.则可能是强碱与弱酸溶液反应 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:
分析:将pH=11的某碱溶液与pH=3的某酸溶液等体积混合,溶液可能为酸性、中性、碱性,主要取决于酸、碱的强弱,一般反应后酸过量显酸性,若恰好完全反应,利用盐类水解分析溶液的酸碱性,以此来解答.
解答:
解:A.若所得溶液呈中性,则生成的盐可能为强酸强碱盐,可能为弱酸弱碱盐,故A正确;
B.若所得的溶液呈碱性,则不可能是生成强碱弱酸盐,应可能为强酸弱碱盐,由pH的关系及等体积混合,碱过量,故B错误;
C.若所得溶液呈酸性,不可能是强酸与弱碱溶液反应,应可能为强碱弱酸盐,由pH的关系及等体积混合,酸过量,故C正确;
D.若所得溶液的pH=5,溶液为酸性,酸过量,则可能是强碱与弱酸溶液反应,故D正确;
故选B.
B.若所得的溶液呈碱性,则不可能是生成强碱弱酸盐,应可能为强酸弱碱盐,由pH的关系及等体积混合,碱过量,故B错误;
C.若所得溶液呈酸性,不可能是强酸与弱碱溶液反应,应可能为强碱弱酸盐,由pH的关系及等体积混合,酸过量,故C正确;
D.若所得溶液的pH=5,溶液为酸性,酸过量,则可能是强碱与弱酸溶液反应,故D正确;
故选B.
点评:本题考查酸碱混合溶液的定性分析,注意pH与酸碱的强弱的关系,注意把握pH的关系判断过量是解答的关键,题目难度中等.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目
用下列实验装置或操作进行相应实验,能达到实验目的是( )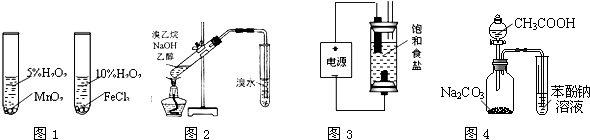

| A、用图1装置验证比较不同催化剂对反应速率的影响 |
| B、用图2所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯 |
| C、用图3装置制备少量含NaClO的消毒液 |
| D、利用图4装置证明酸性:CH3COOH>H2CO3>苯酚 |
通过复习总结,下列归纳正确的是( )
| A、Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物 |
| B、简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性 |
| C、一种元素可能有多种氧化物,但同种化合价只对应有一种氧化物 |
| D、物质发生化学变化一定有化学键断裂与生成,并伴有能量变化,而发生物理变化就一定没有化学键断裂或生成 |
以下微粒含配位键的是( )
①N2H5+ ②CH4 ③OH-④NH4+⑤NH3⑥Fe(SCN)3⑦H3O+⑧[Cu(NH3)4]2+.
①N2H5+ ②CH4 ③OH-④NH4+⑤NH3⑥Fe(SCN)3⑦H3O+⑧[Cu(NH3)4]2+.
| A、①④⑥⑦⑧ | B、①②④⑦⑧ |
| C、③④⑤⑥⑦ | D、全部 |
下列羧酸中,具有四种官能团的是( )
A、 |
B、 |
C、 |
D、 |