题目内容
5.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+,其反应的离子方程式为2Fe3++H2S=Fe2++S↓+2H+;操作Ⅱ,在溶液中用硫酸酸化至pH=2的目的是使Sn2+沉淀完全,防止Fe2+生成沉淀.
(2)操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②降低洗涤过程中FeSO4•7H2O的损耗.
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取一定质量绿矾产品,配制成250.00mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O).
①用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
③若用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有样品中存在少量的杂质或样品部分被氧化.
分析 (1)依据三价铁离子的氧化性和硫化氢的还原性来分析,依据流程关系图分析,在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节溶液PH=2为了除去杂质离子Sn2+;
(2)操作IV的目的是从滤液中析出绿矾晶体,利用蒸发浓缩,结晶洗涤得到晶体;
(3)操作IV得到的绿矾晶体用少量冰水洗涤目的是洗去表面杂质,温度降低绿矾溶解度降低,减少绿矾晶体的损失;
(4)①滴定操作中正确的操作方法是左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化;
②当溶液里有Fe2+时,滴入的酸性高锰钾紫色溶液立即裉色,当溶液里没有Fe2+时,滴入的酸性高锰酸钾溶液紫色不褪去,结合这二种现象确定终点判断;
③因为Fe2+还原性很强,在滴定过程中也有可能被空气中的氧气氧化,另外还有可能本身样品中就含有一定的杂质.
解答 解:(1)Fe3+有强氧化性,H2S有强还原性,二者相遇要发生氧化还原反应,发生反应的离子方程式为2Fe3++H2S=Fe2++S↓+2H+,在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
故答案为:2Fe3++H2S=Fe2++S↓+2H+;使Sn2+沉淀完全,防止Fe2+生成沉淀;
(2)滤液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:蒸发浓缩;冷却结晶;
(3)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,故答案为:降低洗涤过程中FeSO4•7H2O的损耗;
(4)①滴定时为准确判断滴定终点,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化,故答案为:锥形瓶中溶液颜色的变化;
②当溶液里有Fe2+时,滴入的酸性高锰钾紫色溶液立即裉色,当酸性高锰酸钾溶液过量是溶液会显紫色,故滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色为滴定终点,故答案为:滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
③用上述方法测定的样品中FeSO4•7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因是洗涤不彻底,亚铁离子被空气中的氧气部分氧化,故答案为:样品中存在少量的杂质或样品部分被氧化.
点评 本题考查了铁盐亚铁盐的性质应用,分离混合物的实验方法设计和分析判断,滴定实验的分析判断,数据计算,误差分析的方法,题目难度中等.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 常温时56g铁片投入足量浓硫酸中生成NA个SO2分子 | |
| B. | 12g石墨和C60的混合物中质子总数一定为6NA个 | |
| C. | 25℃,pH=12的Na2CO3溶液中含有CO32-的数目为0.01NA | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
| A. | 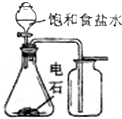 实验室制备并收集乙炔 | B. | 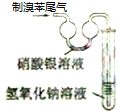 证明溴苯中含溴元素 | ||
| C. | 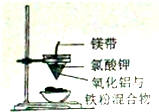 铝热反应 | D. | 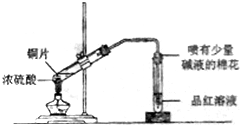 检测铜与浓硫酸反应的气体产物 |
已知:
 ;
;反应物和生成物的物理性质如表:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环已醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环已烯 | 0.81 | -103 | 83 | 难溶于水 |
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝回流反应物.
②试管C置于冰水浴中的目的是防止环己烯(或反应物)挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上层(填上或下),分液后用C(填序号)洗涤:
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液

②再将环己烯按图乙装置蒸馏,冷却水从f(填字母)口进入;蒸馏时要加入生石灰的目的除去水分.
③图乙蒸馏装置收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是cd:
a.蒸馏时从70℃开始收集产品;
b.环己醇实际用量多了;
c.制备粗品时环己醇随产品一起蒸出;
d.是可逆反应,反应物不能全部转化
(3)区分环己烯精品和粗品(是否含有反应物)的方法是取适量产品投入一小块金属钠,观察是否有气泡产生(或测定沸点是否为83℃).
| A. | 相同体积、相同密度的CO和C2H4 | |
| B. | 相同质量、不同密度的N2和C2H4 | |
| C. | 相同压强、相同体积、相同质量的O2和N2 | |
| D. | 相同温度、相同压强、相同体积的O2和N2 |

