题目内容
12.下列反应,既是氧化还原反应,又符合如图反应的是( )
| A. | 铝片和稀盐酸反应 | B. | 灼热的碳与二氧化碳的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 甲烷在氧气中的燃烧 |
分析 含元素化合价变化的反应为氧化还原反应,图中生成物能量大于生成物,为吸热反应,结合反应来解答.
解答 解:A.Al、H元素的化合价变化,为氧化还原反应,但为放热反应,故A不选;
B.C元素的化合价变化,为氧化还原反应,且为吸热反应,故B选;
C.没有元素的化合价变化,为非氧化还原反应,为吸热反应,故C不选;
D.C、O元素的化合价变化,为氧化还原反应,但为放热反应,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、能量变化为解答的关键,侧重分析与应用能力的考查,注意常见反应的热效应及图象分析,题目难度不大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案
相关题目
9.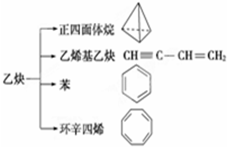 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )| A. | 正四面体烷的分子式为C4H4,其二氯代物有两种 | |
| B. | 苯为平面六边形结构,分子中存在C-C和C═C,能使酸性KMnO4溶液褪色 | |
| C. | 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同 | |
| D. | 环辛四烯跟苯的结构很像,不能使溴水褪色 |
3.有5种元素X、Y、Z、Q、T.X原子M层上有2个未成对电子且M层无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满.下列叙述不正确的是( )
| A. | 元素Y和Q可形成化合物Y3Q4 | |
| B. | T和Z各有一种单质的空间构型为正四面体形,键角都是109°28? | |
| C. | X和Q结合生成的化合物可以形成离子化合物 | |
| D. | ZQ2是极性键构成的非极性分子 |
20.下列有关的离子方程式书写正确的是( )
| A. | NH4Cl溶液和浓的KOH溶液反应:NH4++OH-═NH3•H2O | |
| B. | 铜与稀硝酸反应:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Ag+Cu2+ |
17.某烃分子中有一个由碳碳单键构成的六元环,有一个碳碳双键,还有一个碳碳叁键,则能满足上述条件的烃的分子式可能是( )
| A. | C8H8 | B. | C10H16 | C. | C14H22 | D. | C12H22 |
4.下列有关化学键的说法正确的是( )
| A. | 离子化合物中一定含有离子键,共价化合物中可能含有离子键 | |
| B. | 共价化合物中一定含有共价键,离子化合物中可能含有共价键 | |
| C. | 由非金属元素形成的化合物中一定只含共价键 | |
| D. | 含有金属元素的化合物中一定含有离子键 |
1.下列各组物质中,化学键全部为共价键的是( )
| A. | NH4Cl、CO2、HCl | B. | O2、KF、SO2 | C. | HCl、CH3COOH、CH4 | D. | Na2O2、N2、H2O |
2.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法不正确的是( )
| A. | 1 mol NH5中含有5 NA个N-H键(NA表示阿伏加德罗常数) | |
| B. | NH5中既有共价键又有离子键 | |
| C. | NH5与NH4Cl 中阳离子的电子式相同 | |
| D. | 它与水反应的离子方程式为:NH4++H-+H2O═NH3•H2O+H2↑ |

 ;
; ;
;