题目内容
11.下列有关离子共存的说法或离子方程式的书写中,正确的是( )| A. | 用FeCl3溶液腐蚀铜电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 向NH4HCO3溶液中加入足量NaOH溶液共热:NH4++OH$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 水电离出的c(H+)=1×10-12mol/L溶液中,可能大量共存的离子:K+、CO32-、Na+、S2- |
分析 A.电子、电荷不守恒;
B.漏写碳酸氢根离子与碱的反应;
C.反应生成硫酸钡、硫酸钠和水;
D.水电离出的c(H+)=1×10-12mol/L溶液,为酸或碱溶液.
解答 解:A.用FeCl3溶液腐蚀铜电路板的离子反应为2Fe3++Cu═2Fe2++Cu2+,故A错误;
B.向NH4HCO3溶液中加入足量NaOH溶液共热的离子反应为HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO32-,故B错误;
C.向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7的离子反应为Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C错误;
D.水电离出的c(H+)=1×10-12mol/L溶液,为酸或碱溶液,碱溶液中该组离子之间不反应,可大量共存,故D正确;
故选D.
点评 本题考查离子共存及离子反应方程式书写,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、复分解反应的判断,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
1.同位素示踪法可用于反应机理的研究,下列反应中同位素示踪表示正确的是( )
| A. | 2Na218O2+2CO2═2Na2Cl8O3+O2 | |
| B. | NH4Cl+2H2O?NH3•H2O+HCl | |
| C. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O | |
| D. | 2KMnO4+5H218O2+3H2SO4═K2SO4+2MnSO4+518O2↑+8H2O |
2.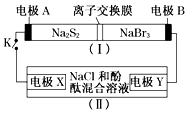 如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.当闭合K时,X极附近溶液先变红色.下列说法正确的是( )
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.当闭合K时,X极附近溶液先变红色.下列说法正确的是( )
 如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.当闭合K时,X极附近溶液先变红色.下列说法正确的是( )
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:2Na2S2+NaBr3$?_{充电}^{放电}$Na2S4+3NaBr.当闭合K时,X极附近溶液先变红色.下列说法正确的是( )| A. | 装置(Ⅰ)中Na+从左到右通过离子交换膜 | |
| B. | A电极的电极反应式为NaBr3+2Na++2e-═3NaBr | |
| C. | X电极的电极反应式为2Cl--2e-═Cl2↑ | |
| D. | 每有0.1 mol Na+通过离子交换膜,X电极上就析出标准状况下的气体1.12 L |
19.下列物质含有离子键的是( )
| A. | N2 | B. | NH3 | C. | CO2 | D. | MgCl2 |
20.下列离子方程式书写正确的是( )
| A. | MgSO4溶液与Ba(OH)2溶液反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 向澄清的石灰水中加入过量NaHCO3溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | 向Al2(SO4)3溶液中加入过量氨水溶液:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 向Ca(ClO)2溶液中通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
1.下列离子方程式中,正确的是( )
| A. | 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 在CuSO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 氯气通入NaOH溶液中:Cl2+OH-═Cl-+ClO-+H2O | |
| D. | 氧化钠投入水中:O2-+H2O-═2OH- |