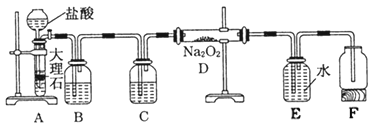
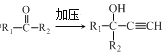
题目内容
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
①常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是_______________(填编号)。
②将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
③室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是__________________,溶液中c(CH3COO-)/c(CH3COOH) =___________
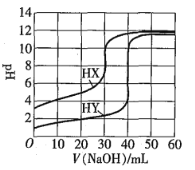
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。

① d点所示的溶液中离子浓度由大到小的顺序依次为__________________________________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=________(用溶液中的其它离子浓度表示)。
【答案】A B C CN-+CO2+H2O=HCN+HCO3- CH3COO-+H2O ![]() CH3COOH+OH- l.8×104 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2c(H+)-2c(OH-)
CH3COOH+OH- l.8×104 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2c(H+)-2c(OH-)
【解析】
先根据K分析酸强弱,根据越弱越水解分析盐的水解程度来得出水解相同氢氧根离子,其浓度大小顺序;
利用相对强的酸制相对弱的酸来分析;
离子发生水解,其离子浓度减小,根据电荷守恒和质子守恒来分析溶液中离子浓度的关系。
⑴根据K越大酸越强得出酸强弱顺序为CH3COOH > H2CO3 > HCN > HCO3-,pH相同,即水解生成的氢氧根浓度相同,水解程度越大,要使水解生成的氢氧根浓度相同,则盐的浓度越小,水解程度Na2CO3 > NaCN > CH3COONa,所以其物质的量浓度大小顺序为CH3COONa > NaCN > Na2CO3
故答案为A B C;
②将少量CO2通入NaCN溶液只能生成碳酸氢根,不能生成碳酸根,故反应的离子方程式是CN-+CO2+H2O=HCN+HCO3-,
故答案为CN-+CO2+H2O=HCN+HCO3-;
③室温下,-定浓度的CH3COONa溶液pH=9,溶液显碱性主要是醋酸根离子水解显碱性,用离子方程式表示溶液呈碱性的原因是CH3COO-+H2O ![]() CH3COOH+OH-,溶液中
CH3COOH+OH-,溶液中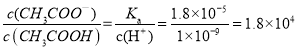 ,
,
故答案为CH3COO-+H2O ![]() CH3COOH+OH-;1.8×104;
CH3COOH+OH-;1.8×104;
⑵① d点所用盐酸的体积为20 mL,该点溶质为氯化铵,由于铵根离子水解,因此离子浓度由大到小的顺序依次为c(C1-)>c(NH4+)>c(H+)>c(OH-),
故答案为c(C1-)>c(NH4+)>c(H+)>c(OH-);
②b点所示的溶质为一水合氨和氯化铵且物质的量浓度相等,根据电荷守恒和质子守恒的得出c(NH4+) + c(H+) = c(C1-) + c(OH-),c(NH4+) + c(NH3·H2O) = 2c(C1-)
2c(NH4+) + 2c(H+) - 2c(OH-)= 2c(C1-) = c(NH4+) + c(NH3·H2O)
所以溶液中c(NH3·H2O)-c(NH4+)=2c(H+) - 2c(OH-),
故答案为2c(H+) - 2c(OH-)。