题目内容
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑥、⑦的原子半径由小到大的顺序为
(2)②、③、⑧的最高价含氧酸的酸性由弱到强的顺序是
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,请写出该化合物的电子式
 结构式
结构式
(4)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称
| 族 周期 |
IA | 0 | ||||||
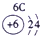
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
O<Si<Al
O<Si<Al
.(2)②、③、⑧的最高价含氧酸的酸性由弱到强的顺序是
H2CO3<HNO3<HClO4
H2CO3<HNO3<HClO4
.(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,请写出该化合物的电子式


H-O-O-H
H-O-O-H
.(4)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称
金刚石
金刚石
、石墨、足球烯或石墨烯
石墨、足球烯或石墨烯
.分析:根据元素在周期表中的位置可判断元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素.
(1)在元素周期表中从左到右原子半径逐渐减小,从上到下逐渐增大;
(2)根据元素的非金属性强弱比较酸性的强弱;
(3)易被催化分解的常见液态化合物是过氧化氢;
(4)②的最高价氧化物为二氧化碳,可被还原为C.
(1)在元素周期表中从左到右原子半径逐渐减小,从上到下逐渐增大;
(2)根据元素的非金属性强弱比较酸性的强弱;
(3)易被催化分解的常见液态化合物是过氧化氢;
(4)②的最高价氧化物为二氧化碳,可被还原为C.
解答:解:(1)在元素周期表中从左到右原子半径逐渐减小,故Si<Al,O<C,从上到下逐渐增大,故C<Si,可知O<Si,
故答案为:O<Si<Al;
(2)元素周期表中,同周期从左到右元素的非金属性逐渐增强,同主族从上到下元素的非金属性逐渐减弱,则非金属性的强弱顺序为Cl>N>C,非金属性越强,对应最高价氧化物的水化物的酸性越强,故有酸性H2CO3<HNO3<HClO4,故答案为:H2CO3<HNO3<HClO4;
(3)氧原子周围6个价电子,氢原子1个价电子,电子式和结构式分别为 、H-O-O-H,,故答案为:
、H-O-O-H,,故答案为: ; H-O-O-H;
; H-O-O-H;
(4)②的最高价氧化物为二氧化碳,可被还原为C,原子的排列为正四面体是的金刚石,碳的同素异形体有石墨、足球烯 或石墨烯等,故答案为:金刚石;石墨、足球烯或石墨烯.
故答案为:O<Si<Al;
(2)元素周期表中,同周期从左到右元素的非金属性逐渐增强,同主族从上到下元素的非金属性逐渐减弱,则非金属性的强弱顺序为Cl>N>C,非金属性越强,对应最高价氧化物的水化物的酸性越强,故有酸性H2CO3<HNO3<HClO4,故答案为:H2CO3<HNO3<HClO4;
(3)氧原子周围6个价电子,氢原子1个价电子,电子式和结构式分别为
 、H-O-O-H,,故答案为:
、H-O-O-H,,故答案为: ; H-O-O-H;
; H-O-O-H;(4)②的最高价氧化物为二氧化碳,可被还原为C,原子的排列为正四面体是的金刚石,碳的同素异形体有石墨、足球烯 或石墨烯等,故答案为:金刚石;石墨、足球烯或石墨烯.
点评:本题考查元素周期表中元素的位置及元素周期律的应用,做题是注意把握题中信息,掌握元素非金属性的判断是解题的关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目









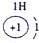
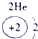
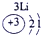
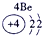
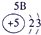
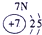
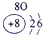
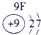
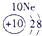
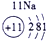





 表示的是
表示的是