题目内容
【题目】汽车尾气中含有CO、NOx等污染物,减少汽车尾气污染是重要研究课题。
(1)已知: N2(g) + O2(g)==2NO(g) △H=+ 180.5kJ·mol-1
2C(s)+ O2(g)== 2CO(g) △H= - 221.0kJ·mol-1
C(s)+ O2(g)==CO2(g) △H= -393.5 kJ·mol-1
2CO(g)+ 2NO(g)== N2(g)+ 2CO2(g) △H=_______kJ·mol-1
(2)某温度下,为探究2CO(g)+ 2NO(g)N2(g)+ 2CO2(g)的反应速率,用气体传感器测得不同时间的CO和NO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO)/10-4mol·L-1 | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
c(NO)/10-4mol·L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
①前2s内,上述反应的平均反应速率v(NO)=_______;
②该温度下,上述反应的平衡常数K=_________;
③对于上述反应,下列叙述正确的是________(填字母)。
A.反应在低温下能自发进行 B.当2v正(CO)=v逆(N2)时,反应达到平衡状态
C.研究反应的高效催化剂意义重大 D.反应达到平衡时,CO、NO的转化率相等
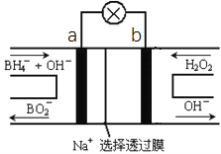
(3)CO浓度分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。写出多孔电极a的电极反应式:_________。

【答案】-746.5 3.75×10-4mol·L-1·s-1 5000 AC CO+O2--2e-=CO2
【解析】
(1)△H=-393.5×2-(﹣221.0)-180.5=746.5 kJ·mol-1;
(2)①v(NO)=(10-2.5)×10-4÷2=3.75×10-4mol·L-1·s-1;
②![]() ,
,
③A. 该反应△H<0,△S<0,所以可在低温下自发反应,A正确;
B. 当v正(CO)=2v逆(N2)时,反应达到平衡状态,B错误;
C.高效催化剂可提高反应效率,意义重大,C正确;
D.CO转化率为(9×10-4)÷(36×10-4)=0.25,NO转化率为(9×10-4)÷(10×10-4)=0.9,D错误;
答案选AC;
(3)电极a是原电池负极,发生氧化反应,故电极反应式为CO+O2--2e- =CO2。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案