题目内容
将amol的Na2O2和bmol的NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应,下列说法错误的是
A.当剩余固体为Na2CO3,排出气体为O2,H2O时,a:b=1:2
B.当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时 1/2<a:b<1
C.当a:b>1时,剩余固体为Na2O2,Na2CO3,NaOH,排出气体为O2
D.当排出的O2和H2O为等物质的量时,则a:b=3:2
D
【解析】
试题分析:A.当剩余固体只有碳酸钠时,则过氧化钠恰好和二氧化碳完全反应,发生的反应方程式为2NaHCO3+Na2O2=2Na2CO3+H2O+1/2O2, a:b=1:2,正确;B. 当剩余固体为Na2CO3,NaOH,排出气体为O2,H2O时,说明过氧化钠、二氧化碳完全反应,水部分反应,发生的反应为2NaHCO3=Na2CO3 +CO2+H2O,2Na2O2+2H2O=4NaOH +O2 2Na2O2 +2CO2 =2Na2CO3 +O2 ,则1/2<a:b<1,正确;C. 当a:b>1时,发生的化学反应为2NaHCO3+2Na2O2=2Na2CO3+2NaOHO2,排出气体为氧气,正确;D. ①2NaHCO3=Na2CO3 +CO2+H2O, ②2Na2O2 +2CO2 =2Na2CO3 +O2,排出的水为b/2-X,氧气的量为(b/4+x/2),当排出的氧气和水为等物质的量时,则(b/2-x)= (b/4+x/2),a:b=2:3,错误;选D。
考点:考查有关过氧化钠和碳酸氢钠的计算。

W、X、Y、Z是短周期元素,其部分性质如下表
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的2/3 |
Z | 第三周期原子半径最小的金属 |
下列说法正确的是
A.Z的氧化物属于碱性氧化物
B.最高价氧化物对应水化物的酸性:Y>X
C.离子半径:Z>W
D.气态氢化物的热稳定性:X>W
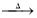 2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S
2CaS3+CaS2O3+3H2O;3Ca(OH)2+6S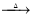 2CaS2+CaS2O3+3H2O
2CaS2+CaS2O3+3H2O



