题目内容
16. 某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为:SO2>I->Fe2+,用如图所示装置进行实验(加热和夹持装置已略,气密性已检验).
某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为:SO2>I->Fe2+,用如图所示装置进行实验(加热和夹持装置已略,气密性已检验).(1)上述实验需要加热的装置是C;
(2)A中反应的化学方程式为Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(3)D中,烧杯盛放的是氢氧化钠溶液;
(4)实验开始时,关闭K1,打开K2,通入少量 氯气,写出B中发生反应的离子方程式2I-+Cl2═I2+2Cl-;
(5)为验证I-的还原性比Fe2+强,取B中的少量溶液于试管中,应再往试管中滴入淀粉溶液溶液,现象是溶液呈蓝色;
(6)在进行完操作(4)后,为了比较SO2和I-的还原性强弱,接下来的操作是A
A.打开K1 B.打开K2 C.同时打开K1和K2
(7)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为0.56L...
分析 (1)二氧化锰和浓盐酸在加热的条件下会发生反应生成氯气;
(2)A中反应为硫酸与亚硫酸钠发生强酸制弱酸的反应;
(3)氯气属于有毒气体,可以用氢氧化钠溶液来吸收;
(4)亚铁离子和碘离子具有还原性,能被氯气氧化,但是碘离子的还原性强于亚铁离子;
(5)碘离子可以被氧化为单质碘,遇到淀粉变为蓝色;亚铁离子能被氧化为三价铁离子,遇到硫氰化钾显示红色;
(6)根据二氧化硫能否和碘单质间的反应可以判断二氧化硫和碘离子的还原性强弱;
(7)根据铁离子和二氧化硫之间的反应方程式进行计算.
解答 解:(1)二氧化锰和浓盐酸在加热的条件下会发生反应生成氯气,所以加热的仪器是C,
故答案为:C;
(2)A中反应为硫酸与亚硫酸钠反应生成硫酸钠、二氧化硫和水,方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;
(3)氯气属于有毒气体,可以用氢氧化钠溶液来吸收,所以D中烧杯盛放的是氢氧化钠溶液,
故答案为:氢氧化钠溶液;
(4)亚铁离子和碘离子具有还原性,能被氯气氧化,但是碘离子的还原性强于亚铁离子,所以少量的氯气可以将碘离子氧化,离子反应为2I-+Cl2═I2+2Cl-,但是不能将亚铁离子氧化,
故答案为:2I-+Cl2═I2+2Cl-;
(5)碘离子可以被氧化为单质碘,碘单质遇到淀粉变为蓝色,据此可以用淀粉检验碘单质的产生,
故答案为:淀粉溶液;溶液呈蓝色;
(6)比较SO2和I-的还原性强弱,可以根据二氧化硫能否和碘单质间的反应来判断,所以可以关闭K2开K1,故答案为:A;
(7)铁离子和二氧化硫之间的反应实质是:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,根据铁元素守恒,铁离子的物质的量是0.05mol,所以消耗二氧化硫的物质的量是0.025mol,体积是:0.025mol×22.4L/mol=0.56L,
故答案为:0.56L.
点评 本题考查学生氯气的性质以及氧化还原反应的综合知识,属于综合知识的考查,侧重考查学生的分析问题的能力、审题能力和基本的计算能力,难度中等.

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案| A. | 盐酸 | B. | 氢氧化铁胶体 | C. | 氢氧化钠溶液 | D. | 氯化钠溶液 |

| A. | 放电时,锂为负极,发生还原反应 | |
| B. | 充电时阳极反应式为:8Li2S-16e-═S8+16Li+ | |
| C. | 电解质可采用导电有机电解质 | |
| D. | 锂硫电池的理论电压为2.0V,则单位质量的单质硫的比能量为3.35 kW•h/kg |
| A. | 1 mol | B. | 1.33 mol | C. | 2 mol | D. | 3 mol |

| A. | 丹参素在C上取代H的一氯代物有4种 | |
| B. | 在Ni催化下1mol丹参素最多可与4molH2加成 | |
| C. | 丹参素能发生取代、消去、中和、氧化等反应 | |
| D. | 1mol丹参素在一定条件下与足量金属钠反应可生成4molH2 |
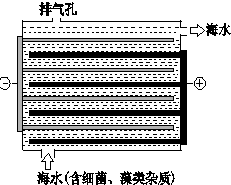 海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.
海洋化学资源的研究和合理利用具有广阔前景,从海水中可提取氯、溴、碘等卤族元素.(1)氯原子结构示意图是
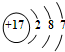 ,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).
,碘在元素周期表中的位置是第五周期ⅦA族,HI的稳定性比HBr弱(填写“强”或“弱”).(2)向浓缩的海水中通入Cl2,可将Br-转化为Br2.再用“空气吹出法”将Br2从浓海水中吹出,并用纯碱浓溶液吸收,生成NaBr、NaBrO3等.当有1mol Br2被纯碱吸收时,转移的电子数为1×1024.
(3)如图是NaClO的发生装置.该装置主要利用了电解饱和食盐水的原理,可实现对海水的消毒和灭藻.
①写出装置中产生NaClO的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,2NaOH+Cl2→NaClO+NaCl+H2O.
海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3.生成CaCO3的离子方程式是Ca2++HCO3-+OH-→CaCO3↓+H2O.
若每隔5-10min倒换一次电极电性,可有效地解决阴极的结垢问题.试用电极反应式并结合必要的文字进行解释阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e→Cl2↑,产生的氯气与水发生反应:Cl2+H2=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.
NaOH溶液吸收SO2得Na2SO3,可用Na2SO3吸收SO2.在SO2被吸收的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
③当吸收液呈中性时,溶液中离子浓度关系正确的是ab(选填字母).
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
d.c(Na+)>c(SO32-)>c(HSO3-)>c(H+)=c(OH-)
| A. | 在标准状况下,NA个水分子所占的体积约为22.4L | |
| B. | 5.6g铁与氯气完全反应,失去电子的数目为0.2NA | |
| C. | 1mol C12发生化学反应,转移的电子数一定为2NA | |
| D. | 在标准状况下,22.4L由N2、N2O组成的混合气体中所含有的氮原子为2NA |


