题目内容
15.某有机物的结构简式为 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 在浓H2SO4催化下能与乙酸发生酯化反应 | |
| D. | 不能在氧气中燃烧 |
分析 有机物含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基,可发生取代、消去和氧化反应,以此解答该题.
解答 解:A.该有机物含有醇羟基,具有醇的性质,所以能与金属钠发生反应并放出氢气,故A正确;
B.该有机物含有碳碳双键,具有烯烃的性质,所以能在催化剂作用下与氢气发生加成反应,故B正确;
C.该有机物含有醇羟基,具有醇的性质,在浓硫酸催化下,能与乙酸发生酯化反应,故C正确;
D.可燃烧生成水和二氧化碳,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握结构中官能团与性质的关系为解答的关键,侧重烯烃、醇等有机物性质的考查,题目难度不大.

练习册系列答案
相关题目
12.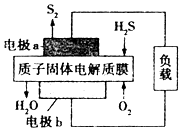 H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )
H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )
 H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )
H2S废气资源利用的途径之一是回收并得到S2(g).反应原理为2H2S(g)+O2(g)═S2(g)+2H2O(1)△H=-632kJ•mol-1.如图所示为H2S燃料电池的结构示意图.下列说法正确的是( )| A. | 电池工作时,电子从电极a经质子固体电解质膜流向电极b | |
| B. | 电极a上发生的电极反应为2H2S+4OH--4e-═S2+4H2O | |
| C. | 当电路中通过2 mol电子时,有2 mol H+经质子固体电解质膜进入正极区 | |
| D. | 当反应中生成64 g S2时,电池内部有632KJ的能量转化为电能 |
6.下列反应既属于氧化还原反应又属于放热反应的是( )
| A. | CH3COOH溶液与NaOH溶液混合 | B. | Al与Fe2O3高温下的铝热反应 | ||
| C. | KMnO4分解制氧气 | D. | Na2CO3在溶液中的水解 |
3.关于物质的用途说法错误的是( )
| A. | 工业上以硫为原料制硫酸 | B. | 二氧化硅用于制造光导纤维 | ||
| C. | 铁在商代用于铸造司母戊鼎 | D. | 铝合金用于制造门窗 |
20.下列有关说法正确的是( )
| A. | 伴有能量变化的物质变化都是化学变化 | |
| B. | 催化剂可以改变化学反应速率但不能改变化学反应的反应热 | |
| C. | 室温下,100mLpH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HA酸性比HB弱 | |
| D. | 对于反应2SO2(g)+O2(g)?2SO3(g)△H<0,压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
7.下列实验方案能达到实验目的是( )
| 选项 | 实验方案 | 实验目的或结论 |
| A | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 | 可证明氧化性:H2O2比Fe3+强 |
| B | 向1mL 1%的NaOH溶液中加入2mL 2%的CuSO4溶液,振荡,再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | 说明Y中不含醛基 |
| C | 取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(已转化为标准状况下) | 测定铝箔中氧化铝的含量 |
| D | 比较不同反应的反应热数据大小 | 从而判断反应速率的大小 |
| A. | A | B. | B | ||
| C. | C D.D |
4.下列叙述错误的是( )
| A. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| B. | 过氧化钠可用于呼吸面具作为氧气的来源 | |
| C. | 氧化铁常用作红色油漆和涂料 | |
| D. | 合金的硬度一般比它的各成分金属的大,熔点一般比它的各成分金属的高 |
5.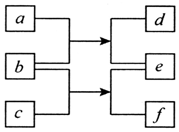 短周期元素W、X、Y、Z的原子序数依次增加,由上述元素组成的各物质转化关系如图所示.其中b为单质,其水溶液显酸性且具有漂白性;d为单质且具有同素异形体;常温下0.0l mol•L-1f溶液的pH<2.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加,由上述元素组成的各物质转化关系如图所示.其中b为单质,其水溶液显酸性且具有漂白性;d为单质且具有同素异形体;常温下0.0l mol•L-1f溶液的pH<2.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增加,由上述元素组成的各物质转化关系如图所示.其中b为单质,其水溶液显酸性且具有漂白性;d为单质且具有同素异形体;常温下0.0l mol•L-1f溶液的pH<2.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加,由上述元素组成的各物质转化关系如图所示.其中b为单质,其水溶液显酸性且具有漂白性;d为单质且具有同素异形体;常温下0.0l mol•L-1f溶液的pH<2.下列说法正确的是( )| A. | 原子半径的大小W<Y<Z | B. | 元素的非金属性Z>X>Y | ||
| C. | Y的氧化物一定为酸性氧化物 | D. | Z的含氧酸一定为强酸 |