题目内容
下列离子方程式正确的是( )
A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO
| ||
| B、BaCO3和盐酸:BaCO3+2H+=Ba2++CO2↑+H2O | ||
| C、铜与盐酸反应:Cu+2H+=Cu2++H2↑ | ||
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A、铝粉投入到NaOH溶液中,是铝和水之间发生的氧化还原反应;
B、BaCO3和盐酸,BaCO3是难溶物应写成化学式,而盐酸是强电解质用离子符号;
C、铜与盐酸不反应,不符合客观事实;
D、AlCl3溶液中加入足量的氨水,一水合氨是弱电解质,应写成化学式.
B、BaCO3和盐酸,BaCO3是难溶物应写成化学式,而盐酸是强电解质用离子符号;
C、铜与盐酸不反应,不符合客观事实;
D、AlCl3溶液中加入足量的氨水,一水合氨是弱电解质,应写成化学式.
解答:
解:A、铝粉投入到NaOH溶液中,是铝和水之间发生的氧化还原反应,正确的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故A错误;
B、BaCO3是难溶物应写成化学式,正确的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,故B正确;
C、铜与盐酸不反应,不符合客观事实,故C错误;
D、一水合氨是弱电解质,应写成化学式,正确的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故D错误;
故选B.
B、BaCO3是难溶物应写成化学式,正确的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,故B正确;
C、铜与盐酸不反应,不符合客观事实,故C错误;
D、一水合氨是弱电解质,应写成化学式,正确的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故D错误;
故选B.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、氧化反应的实质以及是否符合反应实际的角度分析.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
NA表示阿伏加德常数,下列说法正确的是( )
| A、标准状况下,0.5NA个戊烷分子所占的体积为11.2L |
| B、常温常压下,17g氨气所含电子数为10NA |
| C、2.24L氮气所含的原子数为0.2NA |
| D、NA个氧分子的质量为16g |
2013年12月上旬我国东部地区出现了大面积的雾霾天气,严重影响人体健康,还致使高速公路关闭,航班停飞.减少雾霾天气的合理措施是( )
①开发洁净能源②适当控制汽车的使用量③农作物收获后把秸秆燃烧掉④大量植树造林,同时减少树木的砍伐⑤利用太阳能⑥把工厂烟囱造高.
①开发洁净能源②适当控制汽车的使用量③农作物收获后把秸秆燃烧掉④大量植树造林,同时减少树木的砍伐⑤利用太阳能⑥把工厂烟囱造高.
| A、①②④⑤ | B、①②④⑥ |
| C、②③④⑥ | D、①②⑤⑥ |
2011年被联合国大会确定为“国际化学年”.以“化学--我们的生活,我们的未来”为主题庆祝化学对人类文明作出的重要贡献.下列叙述与化学变化无直接关系的是( )
| A、使用防腐剂延长食品保质期 |
| B、利用风力发电,获取清洁能源 |
| C、研发可降解塑料,控制白色污染 |
| D、将汽车尾气中的NO和CO转化为无害气体 |
下列离子方程式中不正确的是( )
| A、氢氧化镁白色沉淀溶于氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3?H2O | ||||
B、铜片接电源正极,碳棒接电源负极,电解硫酸溶液Cu+2H+
| ||||
| C、磷酸一氢钠溶液水解:HPO42-+H2O═PO43-+H3O+ | ||||
| D、漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
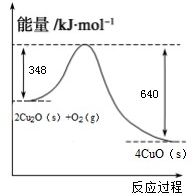 科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.
科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂.