题目内容
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的是
- A.白色沉淀是CuI2,棕色溶液含有I2
- B.滴加KI溶液时,转移1 mol电子时生成1 mol白色沉淀
- C.通入SO2时,SO2与I2反应,I2作还原剂
- D.上述实验条件下,物质的氧化性:Cu2+> SO2> I2
B
溶液变为棕色说明生成了单质碘,即碘化钾作还原剂,则硫酸铜作氧化剂,方程式为2CuSO4+4KI=2CuI+I2+2K2SO4。若再通入二氧化硫,则二氧化硫可被单质碘氧化生成硫酸,方程式为SO2+I2+2H2O=2HI+H2SO4,故物质的氧化性是Cu2+> I2> SO2。所以正确的答案是B。
溶液变为棕色说明生成了单质碘,即碘化钾作还原剂,则硫酸铜作氧化剂,方程式为2CuSO4+4KI=2CuI+I2+2K2SO4。若再通入二氧化硫,则二氧化硫可被单质碘氧化生成硫酸,方程式为SO2+I2+2H2O=2HI+H2SO4,故物质的氧化性是Cu2+> I2> SO2。所以正确的答案是B。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
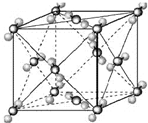 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.