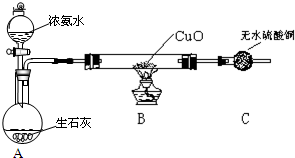
题目内容
3.如图所示,将纯Fe棒和石墨棒插入1L 饱和NaCl溶液中.下列说法正确的是( )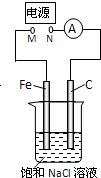
| A. | 去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡 | |
| B. | M接电源负极,N接电源正极,Fe棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| C. | M接电源正极,N接电源负极,将石墨棒换成Cu棒,电解质溶液换成CuSO4溶液,则可实现在铁棒上镀铜 | |
| D. | 去掉电源,将M、N用导线直接相连,烧杯中的溶液换成经酸化的3% NaCl溶液,向Fe电极区滴入2滴K3[Fe(CN)6]溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
分析 A.去掉电源,该装置是原电池,铁发生吸氧腐蚀,铁棒上失电子发生氧化反应;
B.M连接电源负极,N连接正极,则该装置是电解池,铁作阴极,石墨作阳极;
C.M接电源正极,N接电源负极,将C电极换成Cu电极,Fe在阳极失电子;
D.去掉电源,该装置是原电池,铁在负极失去电子生成亚铁离子.
解答 解:A.去掉电源,该装置是原电池,铁发生吸氧腐蚀,铁棒上的电极反应式为:Fe-2e-=Fe2+,故A错误;
B.M连接电源正极,N连接负极,则该装置是电解池,铁作阴极,石墨作阳极,铁不被腐蚀,属于外加电源的阴极保护法,故B错误;
C.M接电源正极,N接电源负极,将C电极换成Cu电极,阳极发生Fe-2e-=Fe2+,阴极发生Cu2++2e-=Cu,不能实现在铁上镀铜,故C错误;
D.去掉电源,该装置是原电池,铁在负极失去电子生成亚铁离子,向Fe电极区滴入2滴K3[Fe(CN)6]溶液,反应一段时间后,烧杯中产生蓝色沉淀,故D正确;
故选D.
点评 本题考查电解池和原电池原理,明确离子放电顺序是解本题关键,注意电解池中如果活泼金属作阳极,则阳极上金属电极失电子而不是溶液中阴离子失电子,为易错点.

练习册系列答案
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
2.一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( )
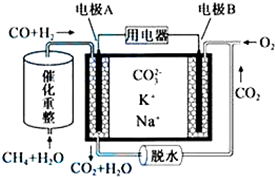

| A. | 反应CH4+H2O$\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1molCH4转移12mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
14.溴苯是不溶于水的液体,常温下不与酸、碱反应,可用如图甲装置制取(该反应放出热量).制取时观察到烧瓶中有大量红棕色蒸气,锥形瓶中导管口有白雾出现等现象.(如图乙)下列说法错误的是( )
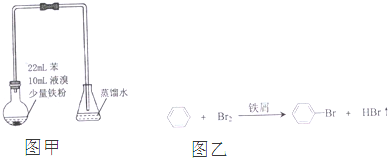

| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗去 |
11.对下列装置的叙述错误的是( )


| A. | X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 | |
| B. | X如果是氯化钠,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 | |
| C. | X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 | |
| D. | X如果是氢氧化钠,将碳电极改为铝电极,a和b用导线连接,此时构成原电池铁作负极 |
18.下列实验的叙述正确的是( )
| A. | 酸碱中和滴定需将标准溶液直接注入到用水清洗后的滴定管中 | |
| B. | 若需94 mL1.00mol/LNaCl溶液,需称5.85g NaCl配制成100mL溶液 | |
| C. | 用一元酸和一元碱测定中和反应热时,取等体积等浓度的稀溶液为佳 | |
| D. | 测定稀酸或稀碱溶液的pH时,需将待测液直接滴在湿润的pH试纸上 |
12.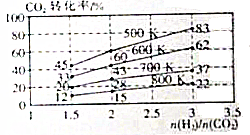 二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247KJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205KJ•mol-1
则反应CO2(g)+4H2(g)?CH2(g)+2H2O(g)的△H3=-165kJ•mol-1
(2)在一定压强下,在某恒定密闭容器中充入H2和CO2发生反应:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
①降低温度,平衡向正方向移动;
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,
H2的转化率为40%若达到平衡后,H2的浓度为a mol•L-1,则达到平衡时CH3CH2OH的浓度为0.1amol•L-1.
(3)CO2和H2在一定条件下可合成二甲醛:2CO2(g)+6H2(g)?CH3OH(g)+3H2O(g)△H.在一定压强下,将2.5mol H2与a mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据都如表:
①x,y的大小关系为B
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z,ω时,达到平衡的时间前者长
D.转化率分别为y,ω时,平衡常数不同.
 二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.(1)二氧化碳重整可用于制取甲烷,已知:
CH4(g)+CO2(g)?2CO(g)+2H2(g)△H1=+247KJ•mol-1
CH4(g)+H2O(g)?CO(g)+3H2(g)△H2=+205KJ•mol-1
则反应CO2(g)+4H2(g)?CH2(g)+2H2O(g)的△H3=-165kJ•mol-1
(2)在一定压强下,在某恒定密闭容器中充入H2和CO2发生反应:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),其起始投料比、温度与CO2的转化率的关系如图所示.
| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
②在700K,起始投料比$\frac{n({H}_{2})}{n(C{O}_{2})}$=1.5时,
H2的转化率为40%若达到平衡后,H2的浓度为a mol•L-1,则达到平衡时CH3CH2OH的浓度为0.1amol•L-1.
(3)CO2和H2在一定条件下可合成二甲醛:2CO2(g)+6H2(g)?CH3OH(g)+3H2O(g)△H.在一定压强下,将2.5mol H2与a mol CO2置于容积为1L的密闭容器中,发生上述反应,达到平衡状态时,测得反应的实验数据都如表:
①x,y的大小关系为B
A.x=y B.x>y C.x<y D.无法判断
②下列关于该反应的叙述正确的是ABC.
A.该反应的△H<0,△S<0
B.该反应的平衡常数随温度升高而减小
C.转化率分别为z,ω时,达到平衡的时间前者长
D.转化率分别为y,ω时,平衡常数不同.
13.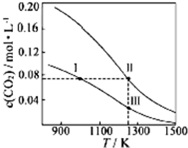 在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
 在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |