题目内容
17.(1)写出下列反应的化学方程式:①工业上电解饱和食盐水制取大量氯气2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
②实验室制氯气时用氢氧化钠溶液吸收尾气Cl2+2NaOH═NaCl+NaClO+H2O.
③氯气和水反应Cl2+H2O=HCl+HClO.
(2)配平下列化学方程式
①3Cu+8HNO3→3Cu(NO3)2+2NO+4H2O
②2KMnO4+16HCl→2MnCl2+5Cl2+2KCl+8H2O.
分析 (1)①电解饱和食盐水生成氯气、氢气和氢氧化钠;
②氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
③氯气与水反应生成氯化氢和次氯酸;
(2)①反应中铜元素化合价从0→+2价,失去2e-,硝酸根中的氮元素化合价从+5价→+2价,得到3e-,依据氧化还原反应得失电子守恒和原子个数守恒规律配平方程式;
②反应中Mn元素从+7价→+2价,得到5e-,Cl从-1价→0价,依据氧化还原反应得失电子守恒和原子个数守恒规律配平方程式;
解答 解:(1)①电解饱和食盐水生成氯气、氢气和氢氧化钠,化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
②氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
③氯气与水反应生成氯化氢和次氯酸,化学方程式:Cl2+H2O=HCl+HClO;
故答案为:Cl2+H2O=HCl+HClO;
(2)①反应中铜元素化合价从0→+2价,失去2e-,硝酸根中的氮元素化合价从+5价→+2价,得到3e-,要使铜失去电子总数等于硝酸根中的氮得到电子总数,则Cu系数为3,NO系数为2,依据原子个数守恒硝酸铜系数为3,则硝酸系数为8,依据氢原子个数守恒,水的系数为4,
方程式为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O;
故答案为:3 8 3 2 4;
②反应中Mn元素从+7价→+2价,得到5e-,Cl从-1价→0价,依据氧化还原反应得失电子守恒,高锰酸钾系数为2,氯气系数为10,依据原子个数守恒,氯化锰系数为2,氯化钾系数为2,则氯化氢系数为16,依据氢原子个数守恒,水系数为8,
方程式:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O,
故答案为:2 16 2 5 2 8
点评 本题考查了化学方程式的书写、氧化还原反应方程式配平,明确反应实质是解题关键,氧化还原方程式配平时应注意得失电子守恒、原子个数守恒规律的应用.

 步步高达标卷系列答案
步步高达标卷系列答案| 实验 | 现象 | 离子方程式 | |
| A | 稀硫酸滴入含酚酞的Ba(OH)2溶液中 | 白色沉淀生成,溶液由红色变无色 | Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O |
| B | 磁性氧化铁(Fe3O4)溶于氢碘酸 | 磁性氧化铁溶解,溶液变棕黄色 | Fe3O4+8H+═Fe2++2Fe3++4H2O |
| C | Ca(OH)2澄清溶液加到氯水中 | 溶液由黄绿色变为无色 | Cl2+2Ca(OH)2═Cl-+ClO-+Ca2++H2O |
| D | 稀硫酸加到KI淀粉溶液中 | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2═2I2+2H2O |
| A. | A | B. | B | C. | C | D. | D |
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
 碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2 和NH3可以合成尿素.
碳的氧化物在工业上有着广泛的应用,如CO 和H2可以合成甲醇,CO2 和NH3可以合成尿素.若在20L的密闭容器中按物质的量之比1:2充入CO和H2,发生反应:
CO(g)+2H2(g)═CH3OH(g).测得平衡时CO得转化率随温度变化及压强的变化如图所示:p2、195℃时,n(H2)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
(2)你认为p1< p2; p2、195℃时,B点,υ正<υ逆.(填“<”“>”或“=”)
(3)p2、195℃时,该反应的化学平衡常数为25.
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | H2(g)+12O2(g)═H2O(g)△H=-285.8kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 |
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
1KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3 稀溶液,将I2 还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是在步骤b后,增加操作:将分液漏斗充分振荡后静置.
(3)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴向上述溶液中加入物质的量浓度为 2.0×10-3mol/L 的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色;
②b中反应所产生的I2的物质的量是1.0×10-5mol.
| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 阿伏加德罗常数是12 kg 12C中含有的碳原子数 | |
| C. | 1 molH2O分子中含有10 mol电子 | |
| D. | 一个NO分子的质量是a g,一个NO2分子的质量是b g,则氧原子的摩尔质量是(b-a)g•mol-1 |
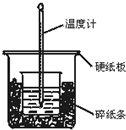 通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题:
通过测定反应过程中所放出的热量可计算中和热.50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在图示的装置中进行中和反应.回答下列问题: