题目内容
2.下列各组顺序的排列不正确的是( )| A. | 原子半径:Na<Mg<Al<Si | B. | 热稳定性:HCl>H2S>PH3>AsH3 | ||
| C. | 酸性:H2SiO3<H2CO3<H3PO4<H2SO4 | D. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 |
分析 A.同周期原子序数大的原子半径小;
B.非金属性越强,氢化物越稳定;
C.非金属性越强,对应最高价氧化物的水化物酸性越强;
D.金属性越强,对应最高价氧化物的水化物碱性越强.
解答 解:A.同周期原子序数大的原子半径小,则原子半径为Na>Mg>Al>Si,故A错误;
B.非金属性越强,氢化物越稳定,则稳定性为HCl>H2S>PH3>AsH3,故B正确;
C.非金属性越强,对应最高价氧化物的水化物酸性越强,则酸性为H2SiO3<H2CO3<H3PO4<H2SO4,故C正确;
D.金属性越强,对应最高价氧化物的水化物碱性越强,则碱性为KOH>NaOH>Mg(OH)2>Al(OH)3,故D正确;
故选A.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
13.提出原子核式结构模型的科学家是( )
| A. | 汤姆生 | B. | 玻尔 | C. | 卢瑟福 | D. | 查德成克 |
10.在C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO的反应中( )
| A. | C作还原剂 | B. | CO2作氧化剂 | ||
| C. | 氧元素化合价降低 | D. | 氧元素化合价升高 |
14.实验室中用CuSO4•5H2O来配制100mL 0.1mol/L CuSO4溶液,需要称量CuSO4•5H2O的质量为( )
| A. | 1.6 g | B. | 2.0 g | C. | 0.01 mol | D. | 2.5 g |
11.据报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点.假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不正确的是( )
| A. | 硅是一种洁净的能源,其燃烧产物SiO2粉尘对环境无污染 | |
| B. | Si在空气中完全燃烧放出的热量多 | |
| C. | 自然界硅的蕴藏量很丰富 | |
| D. | 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料 |
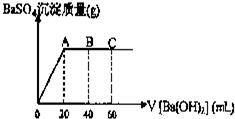 已知在某温度T℃时,某稀硫酸和盐酸混合液中,c(H+)=10-amol•L-1,c(OH-)=10-bmol•L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的质量与加入的Ba(OH)2溶液体积关系如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算:
已知在某温度T℃时,某稀硫酸和盐酸混合液中,c(H+)=10-amol•L-1,c(OH-)=10-bmol•L-1,已知a+b=12.向20mL该混合酸溶液中逐滴加入pH=11Ba(OH)2溶液,生成BaSO4的质量与加入的Ba(OH)2溶液体积关系如图所示,当加入60mL Ba(OH)2溶液时,C点溶液的pH=6(体积变化忽略不计),试计算: )是有机工业的重要原料,可用于合成多种有机物.
)是有机工业的重要原料,可用于合成多种有机物.
 .
. ,合成路线流程图为:
,合成路线流程图为: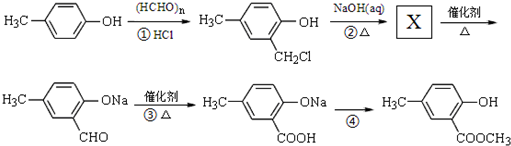
 ;
; 任意一种.
任意一种.