题目内容
常温时将pH=3的CH3COOH溶液与pH=13的NaOH溶液等体积混合后(若混合后两者的体积可以相加),恰好完全反应生成醋酸钠和水,则下列有关所得混合液的说法正确的是( )
| A、所得混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、所得混合液中存在c(CH3COOH)+c(CH3COO-)=0.05mol/L |
| C、混合后溶液pH=7 |
| D、混合后溶液中存c(Na+)+c(H+)=c(OH-)+c(CH3COOH)+c(CH3COO-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:pH=3的CH3COOH溶液与pH=13的NaOH溶液等体积混合后恰好完全反应生成醋酸钠和水,醋酸钠水解使溶液显碱性,结合物料守恒及电荷守恒来解答.
解答:
解:A.醋酸钠水解使溶液显碱性,则c(OH-)>c(H+),且选项A违反电荷守恒,故A错误;
B.由物料守恒可知,c(CH3COOH)+c(CH3COO-)=c(Na+)=
=0.05mol/L,故B正确;
C.醋酸钠水解使溶液显碱性,混合后溶液pH>7,故C错误;
D.由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故D错误;
故选B.
B.由物料守恒可知,c(CH3COOH)+c(CH3COO-)=c(Na+)=
| 0.1mol/L×V |
| 2V |
C.醋酸钠水解使溶液显碱性,混合后溶液pH>7,故C错误;
D.由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故D错误;
故选B.
点评:本题考查酸碱混合时溶液的定性判断,明确醋酸钠溶液的水解是解答本题的关键,注意电荷守恒、物料守恒即可解答,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列做法存在安全隐患的是( )
①将水沿烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌.
②实验室制取氯气时,尾气用碱液吸收.
③取用金属钠或钾做完实验后,剩余的药品要放回原瓶.
④夜间厨房发生煤气泄漏时,立即开灯检查煤气泄漏原因,然后打开所有的门窗通风.
⑤干冰可用于钠、钾、镁等金属的灭火.
①将水沿烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌.
②实验室制取氯气时,尾气用碱液吸收.
③取用金属钠或钾做完实验后,剩余的药品要放回原瓶.
④夜间厨房发生煤气泄漏时,立即开灯检查煤气泄漏原因,然后打开所有的门窗通风.
⑤干冰可用于钠、钾、镁等金属的灭火.
| A、①④⑤ | B、①②③④ |
| C、①③④⑤ | D、全部 |
下列离子方程式书写正确的是( )
| A、氯气跟水反应:Cl2+H2O→2H++Cl-+ClO- |
| B、硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓ |
| C、次氯酸钠溶液中通入CO2:ClO-+CO2+H2O→HCO3-+HClO |
| D、碳酸钙中加入醋酸:CO32-+2CH3COOH→CO2↑+2CH3COO-+H2O |
若用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、32g臭氧中,含有氧原子2NA |
| B、在标准状况下,2.24L苯中所含分子数约为NA |
| C、9g D2O中含有的电子数为5NA |
| D、7.1g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA |
以NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、标准状态下,2.24L氯气与足量水充分反应,转移电子的数目为0.1NA |
| B、常温常压下,1.6g甲醇与肼(N2H4)的混合物中含有电子的数目为0.9NA |
| C、2.9g熟石膏(2CaSO4?H2O)含有的结晶水分子数为0.02NA |
| D、在含有NA个CH3COO-的醋酸溶液中,H+数目为NA |
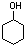 )是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
)是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂. 〔化学--选修3:物质结构与性质〕
〔化学--选修3:物质结构与性质〕